
(8分)用氯化铝溶液与氢氧化钠溶液反应时:
(1)当Al3+的物质的量与OH-的物质的量之比为 时,Al(OH)3沉淀量最多;
(2)当Al3+的物质的量与OH-的物质的量之比 时,Al(OH)3全部溶解;
(3)当Al3+的物质的量与OH-的物质的量之比 或 时,Al(OH)3沉淀量为最多沉淀量的一半。
(1)1/3 (2) 1/4 (3) 2/3或2/7
解析试题分析:(1)Al3++3OH-=Al(OH)3↓;Al3++4OH-=AlO2-+ 2H2O。可见当n(OH-) =3n(Al3+),所有的Al3+恰好完全形成沉淀,达到最大值,当n(OH-) =4n(Al3+),形成的沉淀恰好完全溶解,沉淀达到最小值。若3<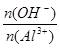 <4,时,沉淀部分溶解,在最大值和最小值之间。若形成的沉淀为最大值的一半,根据反应方程式Al3++3OH-=Al(OH)3↓可知
<4,时,沉淀部分溶解,在最大值和最小值之间。若形成的沉淀为最大值的一半,根据反应方程式Al3++3OH-=Al(OH)3↓可知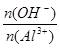 =
=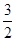 ;当
;当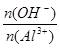 =
=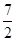 ;形成的沉淀又一半溶解。(1)当Al3+的物质的量与OH-的物质的量之比为1/3时,Al(OH)3沉淀量最多;(2)当Al3+的物质的量与OH-的物质的量之比1/4时,Al(OH)3全部溶解;(3)当Al3+的物质的量与OH-的物质的量之比2/3或2/7时,Al(OH)3沉淀量为最多沉淀量的一半。
;形成的沉淀又一半溶解。(1)当Al3+的物质的量与OH-的物质的量之比为1/3时,Al(OH)3沉淀量最多;(2)当Al3+的物质的量与OH-的物质的量之比1/4时,Al(OH)3全部溶解;(3)当Al3+的物质的量与OH-的物质的量之比2/3或2/7时,Al(OH)3沉淀量为最多沉淀量的一半。
考点:考查氯化铝溶液与氢氧化钠溶液反应时沉淀的物质的量与二者的物质的量的关系的知识。


科目:高中化学 来源: 题型:单选题
将1.12g铁粉加入25mL2mol/L的FeCl3溶液中,充分反应后,其结果是( )
| A.铁恰好将Fe3+全部还原 |
| B.往反应后溶液中滴入KSCN溶液,不显红色 |
| C.溶液变为浅绿色 |
| D.Fe2+和Fe3+物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NaCl是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是( )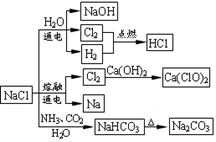
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2与铁不反应 |
| D.图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)某小组进行铝热反应实验,装置如图所示。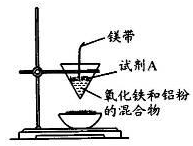
(1)铝热反应原理____(写化学方程式);试剂A为____(写化学式).实验现象____、有黑色固体生成。
(2)对黑色固体物质的组成,小组进行了如下探究
假设I该黑色物质为铁
假设Ⅱ该黑色物质为铁与四氧化三铁的混合物
【设计方案并实验】
| 实 验 步 骤 | 现 象 | 结 论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
| 实验编号 | 实验步骤 |
| 1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 | |
| | ①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: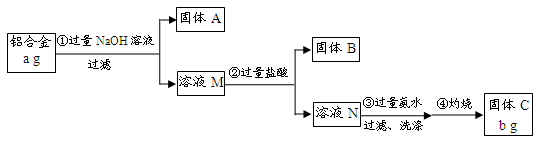
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ;
(2)生成固体B的离子方程式为 ;
步骤③中生成沉淀的离子方程式为 ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
;
(4)该样品中铝的质量分数是 ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ;
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白: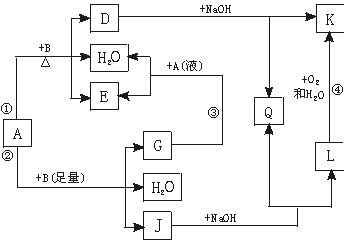
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要的固氮反应。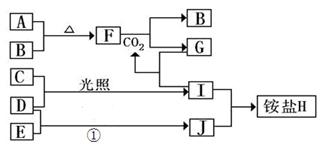
(1)单质E的结构式_____________
(2)F和H2O反应的化学方程式为_____________________________,该反应中被氧化与被还原的物质的物质的量之比是_________________
(3)铵盐H中阳离子的电子式_______________,检验H 中阳离子的方法是____________________
_____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下: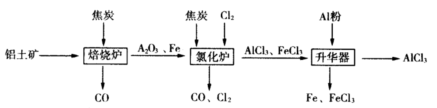
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为 。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式________,与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al): m(Pb)=__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com