
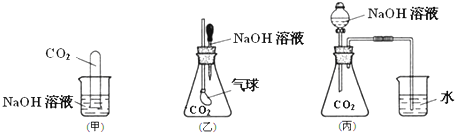
分析 探究CO2与过量的NaOH溶液确实发生了化学反应,
(1)甲装置中二氧化碳和过量氢氧化钠溶液反应生成碳酸钠和水;
(2)氢氧化钠溶液和二氧化碳反应丙装置中气体压强减小,烧杯中水倒吸到丙中;
(3)二氧化碳恒温氢氧化钠反应,压强减小,气球增大可能会爆炸;
(4)依据碳酸根离子、碳酸氢根离子都和酸反应生成二氧化碳气体,碳酸钠和碳酸氢钠和氢氧化钡溶液都会生成碳酸钡白色沉淀,碳酸钠和氯化钡反应生成碳酸钡沉淀,碳酸氢钠和氯化钡不反应;
(5)依据化学反应中碳元素守恒计算应用;
解答 解:(1)甲装置中CO2与过量的NaOH反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O;
故答案为:CO2+2OH-=CO32-+H2O;
(2)丙装置中滴入氢氧化钠溶液,NaOH与CO2反应,导致锥形瓶内压强降低,在大气压的作用下,烧杯中的水倒吸入锥形瓶
故答案:当NaOH溶液滴入锥形瓶之后,烧杯中的水倒吸入锥形瓶;
(3)甲、乙、丙同学设计的三个方案中,乙方案在实际操作中安全性存在问题,因为氢氧化钠滴入和二氧化碳反应后压强减小,气球会膨胀,有可能爆炸,
故答案为:乙;
(4)①碳酸钠和碳酸氢钠与氢氧化钡反应都会生成碳酸钡沉淀,碳酸钠溶液中加入氢氧化钡溶液反应,Ba2++CO32-=BaCO3↓,氢氧化钡溶液加入碳酸氢钠溶液中反应生成沉淀,Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-,故①不符合;
②氯化钡溶液和碳酸钠反应生成白色沉淀,Ba2++CO32-=BaCO3↓,碳酸氢钠和氯化钡溶液不发生反应,故②符合;
③稀盐酸和碳酸钠、碳酸氢钠都发生反应分层二氧化碳气体,不能检验阴离子,故③不符合;
故答案为:②;
(5)实验室中若需用b L CO2 (标准状况),物质的量=$\frac{bL}{22.4L/mol}$=$\frac{b}{22.4}$mol,依据碳元素守恒得到,碳酸钙物质的量为$\frac{b}{22.4}$mol,质量=$\frac{b}{22.4}$mol×100g/mol,现用含CaCO3 a%石灰石与足量的盐酸反应,至少需要这种石灰石质量=$\frac{\frac{100b}{22.4}}{a%}$g=$\frac{10000b}{22.4a}$g,
故答案为:$\frac{10000b}{22.4a}$;
点评 本题考查了物质性质的实验设计和实验方法的应用,主要是二氧化碳和氢氧化钠溶液的反应的产物实验分析方案和实验基本操作,装置中的压强变化是实验装置发生倒吸的原因,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、SO42- | B. | Al3+、OH-、Cl-、Na+ | ||
| C. | NO3-、Cl-、Na+、Ag+ | D. | CO32-、H+、Ca2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s)$\stackrel{△}{→}$Na2CO3(s) | B. | CuCl2$\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{乙醛}$Cu | ||
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | D. | Al2O3(s)$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{通电}{→}$Al(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ns电子的能量可能低于(n-1)p电子的能量 | |
| B. | 6C的电子排布式1s22s22px2反了洪特规则 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应发生的过程中,只放出能量 | |
| B. | 化学反应中的能量通常表现为热量的变化 | |
| C. | 锌与盐酸反应是吸热的过程 | |
| D. | 反应物的总能量高于生成物的总能量为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 甲中△H1=-(△H2+△H3) | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15L | B. | 20L | C. | 23L | D. | 24L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com