
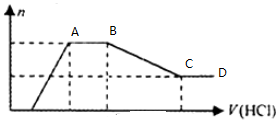
| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
分析 溶液呈无色,说明不含有色离子Cu2+,加入稀盐酸时先不生成沉淀,说明溶液中含有先和盐酸反应的离子,AB段加入稀盐酸时不生成沉淀,BC段加入稀盐酸沉淀减少,说明生成的沉淀能和稀盐酸反应生成可溶性物质,CD段加入稀盐酸沉淀不减少,说明含有不溶于稀盐酸的沉淀,则应该含有SiO32-;BC段说明含有AlO2-
,溶于中含有SiO32-、AlO2-,说明溶液中不含Mg2+、Al3+,根据电荷守恒知,溶液中一定含有Na+,根据图知溶液中还含有CO32-,根据实验现象无法确定是否含有Cl-,据此分析解答.
解答 解:溶液呈无色,说明不含有色离子Cu2+,加入稀盐酸时先不生成沉淀,说明溶液中含有先和盐酸反应的离子,AB段加入稀盐酸时不生成沉淀,BC段加入稀盐酸沉淀减少,说明生成的沉淀能和稀盐酸反应生成可溶性物质,CD段加入稀盐酸沉淀不减少,说明含有不溶于稀盐酸的沉淀,则应该含有SiO32-;BC段说明含有AlO2-,溶于中含有SiO32-、AlO2-,说明溶液中不含Mg2+、Al3+,根据电荷守恒知,溶液中一定含有Na+,根据图知溶液中还含有CO32-,根据实验现象无法确定是否含有Cl-,
A.通过以上分析知,溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl-,故A正确;
B.OA段参加反应的阴离子有SiO32-、AlO2-,因为加入稀盐酸体积未知无法计算两种离子物质的量之比,故B错误;
C.AB段是碳酸氢根离子和氢离子反应生成二氧化碳和水,所以一定生成气体,故C正确;
D.BC段是氢氧化铝和稀盐酸的反应,离子方程式为Al(OH)3+3H+=Al3++3H2O,故D正确;
故选B.
点评 本题考查离子方程式有关计算及离子检验,为高频考点,侧重考查学生图象分析判断能力,明确离子共存条件、离子性质及离子反应先后顺序是解本题关键,注意CO32-、H+反应分两步进行,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石和稀盐酸制取CO2 气体 CO32-+2H+═CO2↑+H2O | |
| B. | 氧化钠和盐酸 O2-+2H+═H2O | |
| C. | 澄清石灰水和稀盐酸 OH-+H+═H2O | |
| D. | 铜和稀硫酸 Cu+2 H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | c(一元酸) | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | c(HX)=0.1mol•L-1 | 0.1 | pH=x |
| 乙 | c(HY)=0.1mol•L-1 | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol•L-1 | 0.1 | pH=9 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 甲烷在氧气中的燃烧 | |
| D. | 白磷自燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
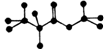
| A. | 该物质在酸性条件下水解生成乙酸 | |
| B. | 该物质含有双键,能跟氢气发生加成反应 | |
| C. | 该物质属于酯类 | |
| D. | 分子式为C3H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
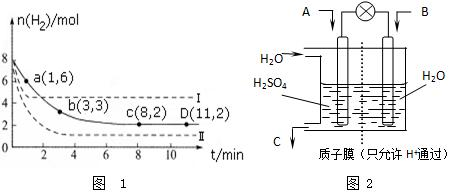
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com