
【题目】黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液25.00 mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 , 放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式?
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为L,制得98%的硫酸质量为t,SO2全部转化为H2SO4时放出的热量是kJ。
【答案】
(1)90.00%
(2)
SO3(g)+H2O(l) =H2SO4(l) ΔH=-130.3 kJ·mol-1
(3)3.36×106;15;3.43×107
【解析】根据题给两个反应可推出SO2与K2Cr2O7的物质的量的关系为3SO2~Cr2O72- , 再根据煅烧黄铁矿反应式4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
可推出 ![]() FeS2~Cr2O72-
FeS2~Cr2O72-
所以n(FeS2)= ![]() n(Cr2O72-)=
n(Cr2O72-)= ![]() ×0.02000 mol·L-1×25.00×10-3 L=
×0.02000 mol·L-1×25.00×10-3 L= ![]() ×10-3 mol
×10-3 mol
所以(1)样品中FeS2的质量分数为 ![]() ×100%=90.00%。(2)因6 g FeS2产生n(SO3)=2×
×100%=90.00%。(2)因6 g FeS2产生n(SO3)=2× ![]() =0.1 mol,与水反应放出热量为13.03 kJ,则1 mol SO3与水反应放出的热量为130.3 kJ,所以热化学方程式为SO3(g)+H2O(l) ====H2SO4(l) ΔH=-130.3 J·mol-1。(3)设煅烧10 t上述黄铁矿理论上产生SO2的物质的量为x。
=0.1 mol,与水反应放出热量为13.03 kJ,则1 mol SO3与水反应放出的热量为130.3 kJ,所以热化学方程式为SO3(g)+H2O(l) ====H2SO4(l) ΔH=-130.3 J·mol-1。(3)设煅烧10 t上述黄铁矿理论上产生SO2的物质的量为x。
则有0.1000 g∶(0.02000 mol·L-1×25.00×10-3 L×3)=10×106 g∶x
x=1.5×105 mol
所以V(SO2)=1.5×105 mol×22.4 L·mol-1=3.36×106 L
根据质量守恒可求出制得98%的硫酸质量为![]() =15 t
=15 t
SO2转化为H2SO4时放出的热量为两部分:一部分为SO2转化为SO3放出的,另一部分SO3转化为H2SO4时放出的,可分别求出后相加而得到答案。
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】有A、B、D、E、F、G六种短周期的主族元素,A的原子半径最小,B的最外层电子数是其所在周期数的2倍,B在D中充分燃烧生成其最高价化合物BD2 , E+与D2﹣具有相同的电子层结构,G与D同主族,A单质在F单质中燃烧的产物溶于水得到一种强酸X.请回答下列问题:
(1)BD2的结构式为 .
(2)G元素在元素周期表中的位置为 , 将GD2作用于新制的F单质的水溶液的离子方程式为 .
(3)在题给元素中含A元素的二元离子化合物的电子式为 , D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为 .
(4)A、B、D三元素所组成的某一元酸Y是日常生活中常见的一种调味剂.在等体积等浓度的X、Y溶液中加入形状相同等质量的锌粒,两者的平均反应速率的大小关系是XY(填“>”或“<”或“=”).
(5)由A、D、E、G四元素可形成两种酸式盐,则这两种酸式盐在水溶液中反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则2min内反应的平均速率VB= , 该反应的化学反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成氨和氨催化氧化的流程如下: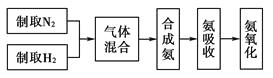
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。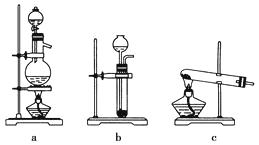
(1)从上图中选择制取气体的合适装置:氮气、氢气。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、。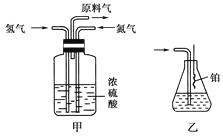
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(“会”或“不会”)发生倒吸;原因是。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是 ,
锥形瓶中还可观察到的现象是。
(5)写出乙装置中氨氧化的化学方程式:。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、、。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法不正确的是 ( )
物质 | 杂质 | 除杂质所用试剂和方法 | |
A | KCl溶液 | I2 | CCl4,萃取 |
B | KNO3 | K2SO4 | Ba(NO3)2溶液,过滤 |
C | Cu | CuO | 盐酸,过滤 |
D | CaCO3 | CaO | 盐酸,过滤 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com