
| A. | 此装置可以实现Cl2的制取、收集、尾气吸收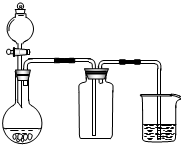 | |
| B. | 此装置可以实现乙酸乙酯的制取和收集 | |
| C. | 此装置可以形成Cu-Zn原电池 | |
| D. | 此装置可证明H2CO3酸性大于H2SiO3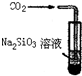 |
分析 A.实验室用二氧化锰和浓盐酸共热制取氯气;
B.乙酸乙酯在碱性条件下可发生水解反应;
C.该装置图中的硫酸铜溶液和硫酸锌溶液应互换,方可构成Cu-Zn原电池;
D.根据“较强酸制较弱酸”分析.
解答 解:A.实验室用二氧化锰和浓盐酸共热制取氯气,该装置缺少加热仪器,故A错误;
B.乙酸乙酯在碱性条件下可发生水解,应把氢氧化钠溶液改为饱和碳酸钠溶液,故B错误;
C.该装置图中的硫酸铜溶液和硫酸锌溶液应互换,方可构成Cu-Zn原电池,故C错误;
D.二氧化碳通入硅酸钠溶液可发生反应Na2SiO3 +CO2+H2O=H2SiO3↓+Na2CO3,说明碳酸的酸性大于硅酸,故D正确;
故选D.
点评 本题考查了气体制备原理和装置、原电池装置、较强酸制较弱酸,综合性较强,难度一般,注意有盐桥的原电池装置中,两种电解质溶液所处的位置.


科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
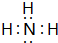 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的平衡常数表达式:K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$ | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
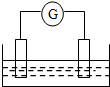 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )
将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )| A. | 固体NaOH | B. | 浓H2SO4 | ||
| C. | Ba(OH)2•8H2O与NH4Cl糊状物 | D. | CaO固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com