
| A�� | V��KOH��=0ʱ����Һ��c��K+��=c��HCO3-��+c��H2CO3�� | |
| B�� | V��KOH��=10mLʱ����Һ��c��HCO3-����c��H2CO3�� | |
| C�� | V��KOH��=20mLʱ����Һ��c��K+����c��CO32-����c��OH-����c��H+�� | |
| D�� | ��V��KOH��=10mLʱ����Һ���£���Һ�У�c��K+����c��OH-����c��CO32-����c��H+�� |
���� A��V��KOH��=0ʱΪ̼�������Һ������̼�������Һ�е������غ��жϣ�
B��V��KOH��=10mLʱ����Ӧ������Ϊ̼��أ�̼��������Ե�һ��ˮ��Ϊ������c��HCO3-����c��H2CO3����
C��V��KOH��=20mLʱ������Ϊ��Ũ�ȵ��������غ�̼��أ�̼������Ӳ���ˮ�⣬��c��OH-����c��CO32-����
D��V��KOH��=10mLʱ����Ӧ������Ϊ̼��أ�ΪKHCO3��Һ��̼������ӵ�ˮ��̶Ƚ�С�����Ⱥ���Ȼ����c��CO32-����c��OH-����
��� �⣺A��V��KOH��=0ʱ��ΪKHCO3��Һ������̼�������Һ�е������غ�ɵã�c��K+��=c��HCO3-��+c��H2CO3��+c��H2CO3������A����
B��V��KOH��=10mLʱ��̼��������������ص����ʵ�����ȣ�ǡ�÷�Ӧ����̼��أ�̼�����Һ��̼��������Ե�һ��ˮ��Ϊ������c��HCO3-����c��H2CO3������B��ȷ��
C��V��KOH��=20mLʱ��KOH����������Ϊ��Ũ�ȵ��������غ�̼��أ�����̼������Ӳ���ˮ�⣬��c��OH-����c��CO32-������Һ������Ũ�ȴ�СΪ��c��K+����c��OH-����c��CO32-����c��H+������C����
D��V��KOH��=10mLʱ����Ӧ������Ϊ̼��أ����Ⱥ�̼������ӵ�ˮ��̶���Ȼ������c��CO32-����c��OH-������Һ����ȷ������Ũ�ȴ�СΪ��c��K+����c��CO32-����c��OH-����c��H+������D����
��ѡB��
���� ���⿼��������Ũ�ȴ�С�Ƚϣ���Ŀ�Ѷ��еȣ���ȷ��Ӧ���������Ϊ���ؼ���ע�����յ���غ㡢�����غ㼰�ε�ˮ��ԭ���ĺ��弰Ӧ�÷���������������ѧ���ķ������������Ӧ��������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��O2�ķ�Ӧ�������ķ��ȷ�Ӧ | |
| B�� | ��˵��������ǿ��ķ�Ӧ��HCl+AgNO3=AgCl��+HNO3 | |
| C�� | ��NaCl��KI�Ļ����Һ�У���μ���AgNO3��Һ���Ȳ�����ɫ��������Ksp��AgCl����Ksp��AgI�� | |
| D�� | ����һ��Ũ�ȵ���������Һʱ��Ӧ�ȼ�ϡ�����ܽ����������壬��ϡ��������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƫ��������Һ | B�� | CaCl2��Һ | C�� | ����ʯ��ˮ | D�� | ��������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
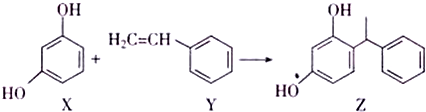
| A�� | X��Y��Z����ʹ��ˮ��ɫ����ԭ����ͬ | |
| B�� | X��Z������Na2CO3��Һ��Ӧ�ų�CO2 | |
| C�� | Z�к�����̼ԭ�� | |
| D�� | Y�����Ӿ۷�Ӧ�ĵ��壬X�������۷�Ӧ�ĵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
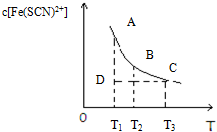 �Ȼ��������軯������Һ�д�������ƽ�⣺Fe3+��aq��+3SCN-��aq��?Fe��SCN��3��aq����ij�Ȼ��������軯�صĻ����Һ�У�Fe��SCN��3�����ʵ���Ũ�����¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵������ȷ���ǣ�������
�Ȼ��������軯������Һ�д�������ƽ�⣺Fe3+��aq��+3SCN-��aq��?Fe��SCN��3��aq����ij�Ȼ��������軯�صĻ����Һ�У�Fe��SCN��3�����ʵ���Ũ�����¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵������ȷ���ǣ�������| A�� | FeCl3��aq����KSCN��aq����Ӧ���Ȼ�ѧ��Ӧ����ʽΪ��Fe3+��aq��+SCN-��aq��=Fe��SCN��3+��aq����H��0 | |
| B�� | �¶�ΪT1��T2ʱ����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2 | |
| C�� | ��Ӧ����D��ʱ��һ����V����V�� | |
| D�� | A����B����ȣ�A���c��Fe3��+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���� | ���� | �ж� |
| A | 1molH2O | ��״���£������ԼΪ22.4L | ��ȷ |
| B | 2gH2 | ���³�ѹ�£���NA������� | ���� |
| C | 1L0.1mol?L-1NaCl��Һ | ȡ��100mL��NaCl�����ʵ���Ũ��Ϊ0.1mol?L-1 | ��ȷ |
| D | 1mol?L-1Na2SO4��Һ | ��1molNa2SO4��������1Lˮ����ø���Һ | ��ȷ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | M+N=P+Q | B�� | M+2N=2P+Q | C�� | 2M+N=2P+Q | D�� | 2M+N=P+2Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2��g��+O2��g���T2H2O��l����H=-285.8KJ•mol-1 | |
| B�� | 2H2��g��+O2��g���T2H2O��l����H=+285.8KJ•mol-1 | |
| C�� | 2H2��g��+O2��g���T2H2O��l����H=-571.6KJ•mol-1 | |
| D�� | 2H2��g��+O2��g���T2H2O��l����H=+571.6KJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com