
| A. | 将白炽灯换成节能灯 | B. | 少开汽车,多骑自行车或坐公交车 | ||
| C. | 用风力发电代替火力发电 | D. | 把高耗能产业转移到欠发达地区 |
分析 哥本哈根气候变化会议焦点议题之一是发展“低碳经济”,减少温室气体排放,以控制日趋严重的温室效应,造成温室效应的主要气体是二氧化碳外,还有臭氧、甲烷、氟氯代烷等.依据上述反应不生成二氧化碳等温室气体分析判断.
解答 解:A.将白炽灯换成节能灯,能够节约电能,有利于节能减排,故A不选;
B.少开汽车,多骑自行车或坐公交车能够减少污染气体的排放,节约能源,有利于节能减排,故B不选;
C.煤燃烧能产生二氧化硫、氮氧化物,破坏环境保护,风力发电能够节约成本,减少污染物的排放,故C不选;
D.把高耗能产业转移到欠发达地区会造成欠发达地区的能源过量消耗,不利于节能减排,不利于欠发达地区的经济发展,故D选;
故选:D.
点评 本题考查了化学与环境污染与防护、能源的利用,明确节能减排的内涵是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
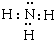 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
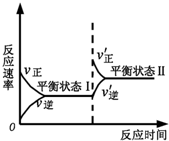
| A. | 反应达平衡时,正反应速率和逆反应速率相等 | |
| B. | 该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| C. | 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| D. | 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
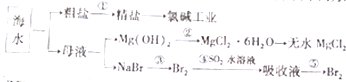 海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )
海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )| A. | 大量的氮、磷废水排入海洋,易引起赤潮 | |
| B. | 空气吹出法是用于工业规模海水提溴的常用方法 | |
| C. | 在过程③中溴元素被氧化,而在过程④中溴元素被还原 | |
| D. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+、等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com