解:Ⅰ(1):浓盐酸的物质的量浓度c=
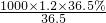
mol/L=12.0mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓盐酸的体积,设浓盐酸的体积为xmL,所以xmL×12.0mol/L=250mL×0.1mol/L,解得:x≈2.1.
所需浓盐酸的体积为2.1mL.
故答案为:2.1mL.
(2)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以操作顺序是BCAFED.
故答案为:BCAFED.
(3)A.溶液具有热胀冷缩的性质,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏高;
B.洗涤液中含有溶质氯化氢,移入容量瓶中溶质氯化氢的物质的量减小,所配溶液浓度偏低;
C.定容时俯视刻度线,导致溶液体积减小,所配溶液浓度偏高;
D.定容时仰视刻度线,导致溶液体积增大,所配溶液浓度偏低.
故选:AC.
Ⅱ(1)实验室用第一个装置制备氯气,反应离子方程式为MnO
2+4H
++2Cl
-=Mn
2++Cl
2↑+2H
2O.因HCl和H
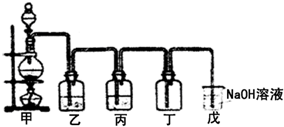
2O的挥发,逸出的氯气中常混有少量氯化氢和水蒸气,若需收集纯净、干燥的氯气,就应进行净化.可依次通过盛有饱和食盐水和浓硫酸的洗气瓶,使氯化氢溶解于饱和食盐水(氯气在饱和食盐水中溶解度大大降低),水蒸气被浓硫酸吸收,经这样的净化处理,氯气就较纯净了,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置收集,
故答案为:①MnO
2+4H
++2Cl
-=Mn
2++Cl
2↑+2H
2O
②饱和NaCl溶液; 除去Cl
2中混有的HCl气体. 浓H
2SO
4.
(2)MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O
4mol 22.4L
0.02L×12.0mol/L=0.24mol V
所以V=
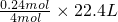
=1.344L=1344 mL.
二氧化锰不能与稀盐酸反应,反应消耗氯化氢,浓盐酸易挥发出氯化氢都会导致盐酸浓度变小.
故答案为:1344 mL; ①部分浓盐酸挥发了;②随着反应的进行浓盐酸变稀,稀盐酸不能被氧化成氯气.
(3)氯气氧化性很强,将碘离子氧化为碘单质,反应离子方程式为Cl
2+2I
-=2Cl
-+I
2,碘水呈棕黄色.
碘在四氯化碳中溶解度远大于水中,四氯化碳密度比水大且不溶于水,所以溶液分层,下层为紫红色,该操作为萃取.
故答案为:棕黄;Cl
2+2I
-=2Cl
-+I
2;紫红;萃取.
(4)次氯酸见光受热易分解,饱和氯水应保存在细口棕色试剂瓶中,放置冷暗处.
故答案为:保存在细口棕色试剂瓶中,放置冷暗处.
分析:Ⅰ(1)根据c=
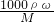
计算浓盐酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓盐酸的体积.
(2)根据配制溶液的实验操作过程进行操作顺序的排序.
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
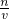
分析判断.
Ⅱ(1)根据实验的目的和反应的原理可知,实验室用第一个装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置吸收氯气.
(2)根据方程式计算理论上可生成标况下的氯气的体积;
二氧化锰与浓盐酸反应生成氯化锰、氯气和水,由于浓盐酸易挥发,随反应进行浓盐酸变稀,稀盐酸不能被氧化成氯气.所以实际值明显少于理论值.
(3)氯气氧化性很强,将碘离子氧化为碘单质,碘水呈棕黄色.
碘在四氯化碳中溶解度远大于水中,四氯化碳密度比水大且不溶于水,所以溶液分层,下层为紫红色.
(4)次氯酸见光易分解,饱和氯水应保存在细口棕色试剂瓶.
点评:本题考查了物质的量浓度溶液的配制及实验室氯气的制备,难度中等,注意从c=
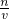
理解配制原理,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累.

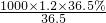 mol/L=12.0mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓盐酸的体积,设浓盐酸的体积为xmL,所以xmL×12.0mol/L=250mL×0.1mol/L,解得:x≈2.1.
mol/L=12.0mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓盐酸的体积,设浓盐酸的体积为xmL,所以xmL×12.0mol/L=250mL×0.1mol/L,解得:x≈2.1. MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O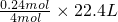 =1.344L=1344 mL.
=1.344L=1344 mL.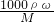 计算浓盐酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓盐酸的体积.
计算浓盐酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓盐酸的体积.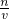 分析判断.
分析判断.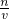 理解配制原理,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累.
理解配制原理,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累. 

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案