
| c2(CO) |
| c(CO2) |
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
| 0.82 |
| 0.22×0.6 |


科目:高中化学 来源: 题型:
| A、②③④⑤ | B、①②④⑤ |
| C、①③④⑤ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
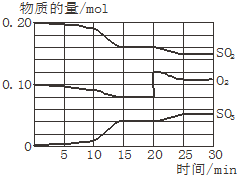 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 已知反应:2CH3COCH3(l)
已知反应:2CH3COCH3(l)| 催化剂 |
| 加热 |
| A、b代表0℃下CH3COCH3的Y-t曲线 | ||
B、反应进行到20min末,用H3COCH3表示的速率之比
| ||
| C、升高温度可缩短反应达平衡的时间并能提高平衡转化率 | ||
D、从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
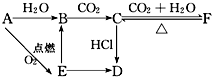 A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铷与水反应的现象与钠相似 |
| B、硝酸铷易溶于水 |
| C、在钠、钾、铷三种单质中,铷的熔点最低 |
| D、氢氧化铷是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础.如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )
卢瑟福的α粒子轰击金箔实验推翻了汤姆森在1903年提出的原子结构模型,为建立现代原子理论打下了基础.如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )| A、abcd | B、abc |
| C、bcd | D、ad |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com