
【题目】下表列出前20号元素中的某些元素性质的一些数据:
元素 | A | B | C | D | E | F | G | H | I | J |
原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是____(填编号)。比元素B原子序数大10的元素在元素周期表中的位置:第____周期第____族,其基态原子的核外电子排布式是___________。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是____(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是_________、___________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。 其分子中共形成____个σ键,____个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第_____周期、第____族。

图(B)是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第____族元素氢化物的沸点的变化规律。不同同学对某主族元素的氢化物的沸点变化趋势画出了两条折线——折线a和折线b,你认为正确的是____,理由是_______________。
【答案】B 4 ⅠB 1s22s22p63s23p63d104s1或[Ar]3d104s1 CO2、CCl4 分子晶体 原子晶体 7 1 三 ⅢA ⅣA b A点所示的氢化物是水,其沸点在氧族元素的氢化物中最高是由于在水分子间存在着氢键,其强度远大于范德华力,而折线a的最高点大于A点,故a不合理,b合理
【解析】
根据最高正价=主族元素的族序数可知,B、H元素最高正价为+1价,因此可知二种元素为第ⅠA族元素,结合半径大小关系可知B为K元素,H为Na元素,A、C最低价为-2价,且C无正价,应为O元素,则A为S元素,F和I最低价都为-3价,应为周期表第ⅤA族元素,由半径大小可知I为N元素,F为P元素,E和J的最高正价为+4价,应为周期表第ⅣA族元素,E为C元素,J为Si元素,G的最高正价为+7价,且原子半径比A小,比C大,应为Cl元素,D最高正价为+3价,应为ⅢA族元素,原子半径比H小,比A大,应为Al元素,据此答题。
由表格中信息可推知:A为S元素、B为K元素、C为O元素、D为Al元素、E为C元素、F为P元素、G为Cl元素、H为Na元素、I为N元素、J为Si元素。
(1)同周期自左向右第一电离能呈增大趋势,同主族自上而下第一电离能呈减小趋势,故上述因素中K元素的第一电离能最小,编号为B,比元素B原子序数大10的元素为Cu元素,处于第4周期ⅠB族,基态原子核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,故答案为:B;4;ⅠB;1s22s22p63s23p63d104s1或[Ar]3d104s1。
(2)O、P、Cl三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是CO2、CCl4、PCl3,元素Cl、N分别与Si形成的两种化合物为SiCl4、Si3N4,前者属于分子晶体,后者属于原子晶体,故答案为:CO2、CCl4;分子晶体;原子晶体。
(3)碳元素、氧元素以及氢元素可形成一种相对分子质量为60的一元羧酸分子,该羧酸为CH3COOH,其分子中共形成7个σ键,1个π键,故答案为:7,1。
(4)因第三和第四电离能之间发生突变,所以该元素最外层有3个电子,处于ⅢA族,线c逐渐上升,标明没有氢键的影响,是第ⅣA族元素氢化物的沸点变化规律,A点所示的氢化物是水,其沸点高时因为水分子间存在氢键,其强度远大于分子间作用力,所以氧族元素中其他氢化物的沸点不会高于水,而折线a的最高点大于A点,故a不合理,b合理,故答案为:三,ⅢA,ⅣA,b,A点所示的氢化物是水,其沸点在氧族元素的氢化物中最高是由于在水分子间存在着氢键,其强度远大于范德华力,而折线a的最高点大于A点,故a不合理,b合理。


科目:高中化学 来源: 题型:
【题目】已知一个碳原子上连有两个羟基时,易发生下列转化:![]() 。请根据如图回答:
。请根据如图回答:

(1)物质A的化学式为C8H10,写出A的名称___,鉴别A和![]() 可选用的试剂是___。
可选用的试剂是___。
(2)写出反应①的化学反应方程式____。
(3)反应①~⑤中,属于加成反应的是____;反应⑤的反应条件为___。
(4)写出2种满足下列条件的 同分异构体的结构简式。___,____。
同分异构体的结构简式。___,____。
①含苯环结构 ②能发生银镜反应
(5)设计由![]() 制备
制备 ![]() 的合成路线(无机试剂任选)。_____
的合成路线(无机试剂任选)。_____
合成路线常用的表示方式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如下:
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90 ℃水解生成A的化学方程式为_________________________________________。“水解”采用90 ℃而不在室温下进行的原因是_________________________________________________;
(2)“酸溶”时,Al2O3发生反应的离子方程式为_____________________;
(3)“氧化”时,发生反应的离子方程式为________________________________;
(4)“废渣”成分为________(填化学式);
(5)采用喷雾干燥而不用蒸发的原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是( )
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是( )
A.x=2
B.2min时,容器内的压强为开始时的80%
C.2min时,B的反应速率为0.1mol·L-·min-
D.A的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
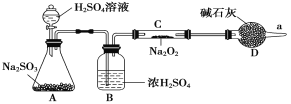
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成S、C、Si三种元素的非金属性强弱比较的实验研究。乙同学设计了如图装置来验证卤族元素的性质递变规律,A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
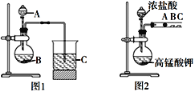
(1)如图中仪器A的名称是____。甲同学实验步骤:连接仪器、______、加药品、滴入试剂。
(2)①如图中仪器A中盛放试剂稀硫酸,烧瓶B中的盛放试剂为___溶液,C中的盛放试剂为______溶液。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________。
(3)如图中A处反应的离子方程式为__________。
(4)乙同学发现如图中B处试纸变蓝,C处红纸褪色,据此____(填“能”或“不能”)得出溴的非金属性强于碘,理由是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com