
����ͼ��ʾ��װ�ý���ʵ�飺
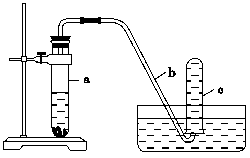
(1)��ʵ�鿪ʼǰ����������ʵ�������
��2�����Թ�a�м���10 mL6 mol/L��ϡHNO3��1 g CuƬ�������ô��е��ܵ���Ƥ�������Թܿڣ���д�����Թ�a���п��ܷ����ķ�Ӧ�Ļ�ѧ����ʽ
_________________________________________________________________________________________________________________________________________________________��
(3)ʵ������г�����Ӧ��ʼʱ���ʻ���������ӿ죬��������_______ _________������Ӧ����һ��ʱ���������������ԭ���� _��
(4)���Ͽ���Ƶ�NO���ɲ�ȡ�Ĵ�ʩ��________��
A������ B��ʹ��ͭ�� C��ϡ��HNO3 D������ŨHNO3
 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ԫ�����ʵ������Ա仯������(����)
A��ԭ�Ӱ뾶�������������� B�����ϼ�
C��ԭ�Ӻ�����ӽṹ D�������Ժͷǽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��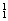 H��
H��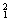 H��
H��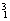 H��
H�� 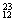 Mg��
Mg��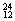 Mg��
Mg�� O��
O��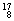 O��
O��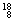 O�й���______��Ԫ�أ�______�ֺ��أ������������� ��D218O����Է���������______��
O�й���______��Ԫ�أ�______�ֺ��أ������������� ��D218O����Է���������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ڷ�Ӧ2X(g)��Y(g)
���ڷ�Ӧ2X(g)��Y(g)  2Z(g)�ڲ�ͬ�¶�(T1��T2)��ѹǿ(p1��p2)�²���Z�����ʵ���n(Z)�ͷ�Ӧʱ��t�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����
2Z(g)�ڲ�ͬ�¶�(T1��T2)��ѹǿ(p1��p2)�²���Z�����ʵ���n(Z)�ͷ�Ӧʱ��t�Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����
A��T1<T2��p1<p2������ӦΪ���ȷ�Ӧ
B��T1<T2��p1>p2������ӦΪ���ȷ�Ӧ
C��T1>T2��p1>p2������ӦΪ���ȷ�Ӧ
D��T1>T2��p1<p2������ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Է���Ӧ���á�H�о������͵���
A��������Է�������ˮ
B��2N2O5(g) = 4NO2 (g) + O2(g) ��H = + 156.7kJ/mol
C��(NH4)2CO3(s) = NH4HCO3(s) + NH3(g) ��H =+74.9 kJ/mol
D��2H2(g) + O2(g) = 2H2O(l) ��H =-285.8kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з�Ӧ������������ԭ��Ӧ���������ȷ�Ӧ����
A.п����ϡ���ᷴӦ B.���ȵ�ľ̿��CO2��Ӧ
C.��������������ĩ��Ӧ D.Ba(OH)2��8H2O������NH4Cl���巴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������������1:1�����һ�Թ��в�������ˮ������ڹ���������ͼ��ʾ�����������У�����ȷ����
A.ƿ������Ļ���ɫ��dz B.ƿ�ڱ�����״Һ���γ�
C.�˷�Ӧ��������ֻ��һ�ȼ��� D.�Թ���Һ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ԫ�����ڱ���ij�����һЩԪ�ض���������뵼����ϣ�������
A����������Ԫ��
B��Ԫ�����ڱ��е�3��12�еĹ���Ԫ��
C������Ԫ�غͷǽ���Ԫ�طֽ��߸�����Ԫ��
D�����·�����Ľ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ��ɫ��Һ�����п��ܺ���Fe3+��Al3+��Fe2+��Mg2+��Cu2+��NH4+��K+��
CO32����SO42�������ӵļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й���������ͼ��ʾ��





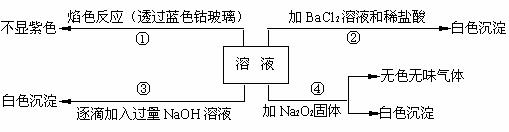
��1����ԭ��Һ��һ�������ڵ������� ��
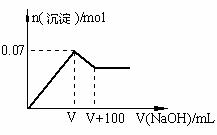
��2���ڢ۸�ʵ���У���ȡԭ��Һ�����Ϊ100 mL��
�μӵ�NaOH��Һ�����ʵ���Ũ��Ϊ0.5 mol��L��1 ��
���ɰ�ɫ�������������NaOH��������ͼ��ʾ����
����ϵ�������Һ�����������ӵ����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com