
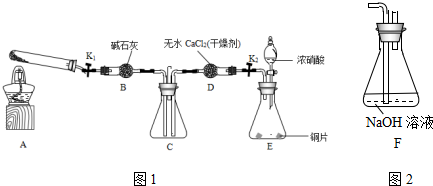
分析 (1)浓硝酸和铜反应生成硝酸铜、二氧化氮和水;
(2)若NO2能够被NH3还原,则混合气体的颜色将变浅;
(3)实验过程中,未能观察到C装置中的预期现象,说明二氧化氮反应的量很少,可能是反应速率降低,或者二氧化氮的转化率较低;
(4)有毒气体不能直接排空;
(5)NO2能被Na2O2还原;
(6)①验证假设2,首先要制取二氧化氮,因为水能和过氧化钠反应,所以要除去水的干扰,使二氧化氮气体通过过氧化钠,最后要进行尾气处理;
②过氧化钠变成白色固体且为纯净物,根据氧化还原反应中元素化合价的变化确定生成物.
解答 解:(1)浓硝酸和铜反应生成硝酸铜、二氧化氮和水,反应方程式为:Cu+4HNO3 (浓)═Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3 (浓)═Cu(NO3)2+2NO2↑+2H2O;
(2)二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则C装置中混合气体颜色变浅,
故答案为:C装置中混合气体颜色变浅;
(3)造成未能观察到C装置中的预期现象可能原因是:在此条件下,该反应的化学反应速率极慢或NO2的转化率极低导致反应现象变化不明显,
故答案为:在此条件下,该反应的化学反应速率极慢;
(4)二氧化氮是有毒气体,氨气是有刺激性气味的气体,所以都不能直接排空,要进行尾气处理才能排空,
故答案为:缺少尾气吸收装置;
(5)NO2能被Na2O2还原,故答案为:NO2能被Na2O2还原;
(6)①验证假设2,首先要用E装置制取二氧化氮,因为制取的二氧化氮气体中含有水蒸气,水能和过氧化钠反应而造成干扰,所以要用D装置除去水蒸气,然后较纯净的二氧化氮通过B装置,未反应的二氧化氮有毒不能直接排空,所以最后要进行尾气处理,选用F装置处理尾气,所以装置的合理连接顺序是EDBDF或EDBF,
故答案为:EDBDF或EDBF;
②B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成,过氧化钠作氧化剂,则二氧化氮中氮元素失电子化合价升高而作还原剂,所以氮元素只能转化为+5价,且生成物是纯净物,所以是硝酸钠,反应方程式为2NO2+Na2O2═2NaNO3,
故答案为:2NO2+Na2O2═2NaNO3.
点评 本题考查了探究二氧化氮性质的实验,根据元素的化合价来预测物质具有的性质,然后根据实验现象判断物质具有的性质,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合反应均为氧化还原反应 | B. | 金属氧化物均为碱性氧化物 | ||
| C. | 烧碱、纯碱、熟石灰都是碱 | D. | BaSO4、NaOH、HNO3都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化碘能与金属和非金属反应 | B. | 它可与水反应:IBr+H2O→HBrO+HI | ||
| C. | 它可KI溶液反应 KI+IBr→KBr+I2 | D. | 固体溴化碘是一种分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维在信息领域应用越来越广泛,其主要成分是硅单质 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂 | |
| C. | 明矾常用于水体杀菌消毒 | |
| D. | 中秋将至,为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应释放或吸收能量的多少与发生反应的反应物的物质的量有关 | |
| B. | 人们可以利用氧化还原反应设计原电池以获取电能 | |
| C. | 人们可以利用C2H2(乙炔)与O2的化学反应获取热能或电能或光能 | |
| D. | MnO4-+5e-+8H+═Mn2++4H2O可能是某原电池里的负极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com