
【题目】I.已知:反应aA(g)+bB(g)cC(g),某温度下,在2 L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为___。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:甲:v(A)=0.3 mol·L-1·s-1,乙:v(B)=0.12 mol·L-1·s-1,丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为_______________。
II.298 K时,将20 mL 3x mol·L-1 Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO![]() (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq)![]() AsO
AsO![]() (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

(1)下列可判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO![]() )
)
c.![]() 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
(2)tm时,v正____v逆(填“大于”“小于”或“等于”)。
(3)tm时v逆____tn时v逆(填“大于”“小于”或“等于”),理由是________。
III.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。溶液中OH-向电极__(填“a”或“b”)移动,负极的电极反应式为:___。

【答案】3A(g)+B(g)2C(g) 乙>甲>丙 ac 大于 小于 tm时生成物浓度较低,逆反应速率较小 a 2NH3-6e-+6OH-=N2+6H2O
【解析】
I.(1)4s内,v(A)=![]() =0.075mol·L-1·s-1,前4 s内v(C)=0.05mol·L-1·s-1,速率之比等于化学计量数之比可知a:c=3:2,12s平衡时,A减少0.6mol·L-1、B减少0.2mol·L-1,可知a:b=3:1;
=0.075mol·L-1·s-1,前4 s内v(C)=0.05mol·L-1·s-1,速率之比等于化学计量数之比可知a:c=3:2,12s平衡时,A减少0.6mol·L-1、B减少0.2mol·L-1,可知a:b=3:1;
(2)化学反应速率与化学计量数的比值越大、反应速率越快;
II.(1)达到平衡时,正逆反应速率相等,各物质的浓度不变;
(2)反应从正反应开始进行,tm时反应继续正向进行;
(3)物质的浓度越大,反应速率越大;
III.a电极通入氨气生成氮气,说明氨气被氧化,为原电池负极,则b为正极,氧气得电子被还原,结合电极方程式解答该题。
I.4s内,v(A)=![]() =0.075mol·L-1·s-1,前4 s内v(C)=0.05mol·L-1·s-1,速率之比等于化学计量数之比可知a:c=3:2,12s平衡时,A减少0.6mol·L-1、B减少0.2mol·L-1,可知a:b=3:1,则该可逆反应为3A(g)+B(g)2C(g),故答案为:3A(g)+B(g)2C(g);
=0.075mol·L-1·s-1,前4 s内v(C)=0.05mol·L-1·s-1,速率之比等于化学计量数之比可知a:c=3:2,12s平衡时,A减少0.6mol·L-1、B减少0.2mol·L-1,可知a:b=3:1,则该可逆反应为3A(g)+B(g)2C(g),故答案为:3A(g)+B(g)2C(g);
(2)甲:v(A)=0.35mol·L-1·s-1;乙:v(B)=0.125mol·L-1·s-1;丙:v(C)=9.65mol·L-1·s-1,![]() ,则甲、乙、丙三个容器中反应速率由快到慢的顺序为乙>甲>丙,故答案为:乙>甲>丙;
,则甲、乙、丙三个容器中反应速率由快到慢的顺序为乙>甲>丙,故答案为:乙>甲>丙;
II.①a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a选;
b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO![]() ),故b不选;
),故b不选;
c.![]() 不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c选;
不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c选;
d.由图可知,当c (AsO![]() )=y mol·L-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2y mol·L-1,所以c(I-)=y mol·L-1时没有达到平衡状态,故d不选;
)=y mol·L-1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=2y mol·L-1,所以c(I-)=y mol·L-1时没有达到平衡状态,故d不选;
故答案为:ac;
②反应从正反应开始进行,tm时反应继续正向进行,则tm时,v正大于v逆,故答案为:大于;
③tm时比tn时AsO![]() 浓度更小,则逆反应速率更小,则tm时v逆小于tn时v逆,故答案为:小于;tm时生成物浓度较低,逆反应速率较小;
浓度更小,则逆反应速率更小,则tm时v逆小于tn时v逆,故答案为:小于;tm时生成物浓度较低,逆反应速率较小;
III.因为a极为负极,则溶液中的阴离子向负极移动,负极是氨气发生氧化反应变成氮气,且OH-向a极移动参与反应,故电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为:a;2NH3-6e-+6OH-=N2+6H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。
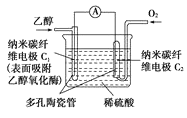
已知C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+,下列有关说法不正确的是( )
A. C1极为电池负极,C2极为电池正极
B. 电子由C2极经外电路导线流向C1极
C. C2极的电极反应式为O2+4H++4e-=2H2O
D. 该生物燃料电池的总反应式为:C2H5OH+3O2=2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃,由任意比例组成的混合气体1L,在9L过量的氧气中充分燃烧后,恢复到反应前的温度,体积仍为10L,则该混合气体的成分可能是
A. C2H4和C3H4B. CH4和C2H6C. CH4和C2H2D. C2H6和C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是

A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 丙烯的结构简式为CH2CHCH3
B. 新戊烷的二氯代物有2种
C. 分子式为CH4O和C2H6O的物质一定互为同系物
D. 键线式为 的有机物的分子式为C8H10
的有机物的分子式为C8H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4。利用下列装置分四步从含NaIO3的废液中制取单质碘的CC14溶液,并回收NaHSO4。下列装置中不需要的是( )
A.制取SO2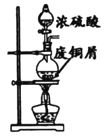
B.还原IO3-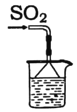
C.制I2的CCl4溶液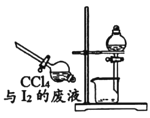
D.从水溶液中提取NaHSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数。下列说法正确的是
A. 标准状况下,22.4LCH4中含有氢原子数目为4NA
B. 1molNa2O2中含有的阴离子和阳离子的数目都是2NA
C. 0.1mol/LCu(NO3)2溶液中含有的NO3-数目为0.2NA
D. 28gN2中所含的原子数目是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“清肺排毒汤”对新冠肺炎病毒感染具有良好的效果,其中一味中药黄芩的一种活性中间体的结构为: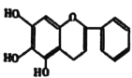 ,现在可人工合成,路线如图所示:
,现在可人工合成,路线如图所示:
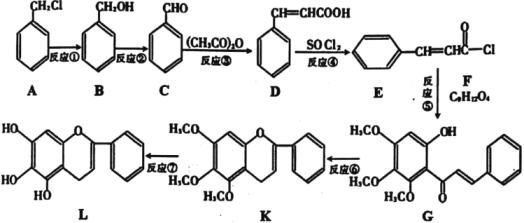
(1)A生成B的反应条件是___,B生成C的反应条件为___。
(2)合成过程中,属于取代反应的是___。
(3)F的结构简式为___。
(4)D在一定条件下能生成高分子化合物,请写出该反应的化学方程式___。同时符合下列三个条件的D的同分异构体共有___种。
a.能发生银镜反应;
b.苯环上有3个取代基;
c.与FeCl3溶液发生显色反应。
(5)依据以上合成信息,以乙烯和氯苯为原料合成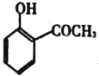 路线,无机试剂自选___。
路线,无机试剂自选___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
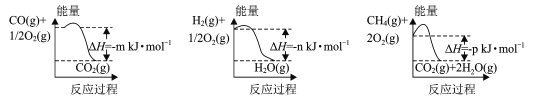
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 ___________。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
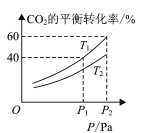
①反应过程中,表明反应达到平衡状态的标志是______;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 ___T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___(不必化简,可以不带单位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com