
 2CO2��g��
2CO2��g�� ������=v���棩ʱ��������Ũ�ȴ������к㶨��ϵ��
������=v���棩ʱ��������Ũ�ȴ������к㶨��ϵ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����̼������Һ���ݹ�¯ˮ����CaSO4+CO32- |
B���Ȼ�ѧ����ʽC2H2��g��+ O2��g�� O2��g�� |
C�����缫���MgCl2������Һ��MgCl2 |
| D��H+��aq��+OH��aq�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ij��Ӧ������������ʴ��ڷ�Ӧ�������ʱ����Ӧ���ȣ���H��0 |
| B����ѧ��Ӧ�����У��������ʱ仯��ͬʱ��һ�����������仯 |
| C��SO2������ˮ��������Һ�ܵ��磬����SO2�ǵ���� |
| D������ij��Ӧ�ķ�Ӧ�ȿ���������ļ����ܺͼ�ȥ��Ӧ��ļ����ܺ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������������������������ֱ���ȫȼ�գ����߷ų������� |
| B���ɡ���(ʯī)����(���ʯ)����H=1.9kJ��mol-1����֪�����ʯ��ʯī�ȶ� |
| C���ڣ�����kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)��2H2O(l)����H="285.8" kJ��mol-1 |
| D��CaCO3(s)=CaO(s)+CO2(g)��H>0����S>0���÷�Ӧ�ڸ��������Է����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������������Ӧ�����Ȼ��ƺ���ṹ���ȶ�����ǿ����ϵ���������� |
B�����ʵ�ȼ�տ� �Կ���Ϊ�����桱�������ڲ�����������ѧ�ܣ�ת��Ϊ�����ͷų��� �Կ���Ϊ�����桱�������ڲ�����������ѧ�ܣ�ת��Ϊ�����ͷų��� |
| C�����������ڲ������ź�ǿ�Ĺ��ۼ�����ͨ������µ����Ļ�ѧ���ʺܻ��� |
| D����Ҫ���Ȳ��ܷ����ķ�Ӧ��һ�������������ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����֪298Kʱ��2SO2(g)��O2(g)  2SO3(g) ��H=��197kJ/ mol���Ը��Ȼ�ѧ����ʽ����Ϊ���ڸ������£����ܱ�������ͨ��2ĦSO2��1ĦO2���ﵽƽ��ʱ�ų�������197 kJ 2SO3(g) ��H=��197kJ/ mol���Ը��Ȼ�ѧ����ʽ����Ϊ���ڸ������£����ܱ�������ͨ��2ĦSO2��1ĦO2���ﵽƽ��ʱ�ų�������197 kJ |
| B��CO(g)��ȼ������283.0kJ/mol����2CO2(g)===2CO(g)��O2(g)��Ӧ�ġ�H��+��2��283.0��kJ/mol |
| C�����ȷ�Ӧ��ָ��Ӧ�������е����������������������е��������������ǿ���Ӧ�����Ƿ���Ҫ���� |
| D�������з�Ӧ��HCl(aq) + NaOH(aq)="NaCl(aq)" + H2O(l)��H=��Q1kJ/mol |
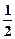 H2SO4(Ũ)+NaOH(aq)=
H2SO4(Ũ)+NaOH(aq)= 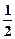 Na2SO4(aq)+H2O(l) ��H=��Q2kJ/mol
Na2SO4(aq)+H2O(l) ��H=��Q2kJ/mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��S
��S �ͨS
�ͨS ��Ĺ�ϵ��ȷ����
��Ĺ�ϵ��ȷ���� =�S
=�S + 4�S
+ 4�S B �S
B �S =�S
=�S + �S
+ �S
 =�S
=�S �� 4�S
�� 4�S D. �S
D. �S =�S
=�S - �S
- �S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ͬ�����£�2mol��ԭ�������е�����С��1mol����������е����� |
B��ͬ��ͬѹ�£�H2(g)+Cl2(g)=2HCl(g)�ڹ��պ͵�ȼ������ ��ͬ ��ͬ |
C��ij������Һ�� ��������Һϡ��10������Һ�� ��������Һϡ��10������Һ��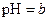 ����b��a+1 ����b��a+1 |
D��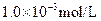 ����� ����� ,1.0��10-8mol�ML����� ,1.0��10-8mol�ML����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com