
【题目】如图所示: 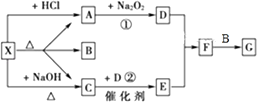
图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体,请填写下列空白:
(1)物质X可以是 , C是 , F是 .
(2)反应①的化学方程式是 , 反应②的化学方程式是
【答案】
(1)(NH4)2CO3或NH4HCO3;NH3;NO2
(2)2Na2O2+2CO2═2Na2CO3+O2;4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
【解析】解:X既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3 , 气体A能与过氧化钠反应,故A为CO2 , 则A应为(NH4)2CO3或NH4HCO3 , B为H2O,结合转化关系可知,D为O2 , E为NO,F为NO2 , G为HNO3 , (1)由上述分析可知,物质X可以是(NH4)2CO3或NH4HCO3 , C是NH3 , F是NO2 , 所以答案是:(NH4)2CO3或NH4HCO3;NH3;NO2;(2)反应①的化学方程式是:2Na2O2+2CO2═2Na2CO3+O2 , 反应②的化学方程式是:4NH3+5O2 ![]() 4NO+6H2O,
4NO+6H2O,
所以答案是:2Na2O2+2CO2═2Na2CO3+O2;4NH3+5O2 ![]() 4NO+6H2O.
4NO+6H2O.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】已知海水略呈碱性,钢铁在其中易发生电化腐蚀,有关说法正确的是( )
A.腐蚀时电子从碳转移到铁
B.在钢铁上连接铅块可起到防护作用
C.正极反应为O2+2H2O+4e﹣=4OH﹣
D.钢铁在淡水中易发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 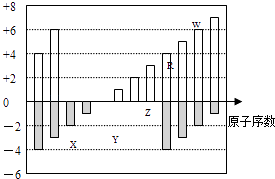
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2
C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-=2H2O
D.工业冶炼金属铝的方法是电解熔融的氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式.
(1)铁与水蒸气在高温下:
(2)苛性钠腐蚀玻璃:
(3)制取漂白粉:
(4)稀硝酸与铜片:
(5)氨的催化氧化:
(6)铜片在浓硫酸中加热: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以等物质的量混合的NaHCO3和KHCO3的混合物a g与100 mL盐酸反应.(题中涉及的气体体积以标准状况计,填空时可以用带字母的数学式表示,不必化简)
(1)该混合物中NaHCO3和KHCO3的质量比为 .
(2)如果反应后盐酸不足量,要计算生成CO2的体积,还需知道 , 理由是 .
(3)若该混合物与盐酸恰好完全反应,则盐酸的物质的量浓度为
(4)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时,生成CO2的体积(V)的取值范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由事实得出的结论错误的是( )
A.维勒用无机物合成了尿素,突破了无机物与有机物的界限
B.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
C.C60是英国和美国化学家共同发现的,体现了国际科技合作的重要性
D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图中,甲烧杯中盛有100mL 0.50molL﹣1 AgNO3溶液,乙烧杯中盛有100mL 0.25molL﹣1CuCl2溶液,A,B,C,D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则 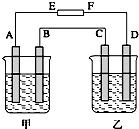
(1)电源E为极,F为极.
(2)A极的电极反应式为 , 析出物质mol.
(3)B极的电极反应式为 , 析出气体mL(标).
(4)C极的电极反应式为 , 析出的物质mol.
(5)D极的电极反应式为 , 析出气体mL(标况).
(6)甲烧杯中滴入石蕊试液,极附近变红,若继续电离,在甲烧杯中最终得到溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物之间的相互转化可用下式表示:Fe2+ ![]() Fe3+
Fe3+ ![]() FeO
FeO ![]() (高铁酸根离子)回答下列有关问题:
(高铁酸根离子)回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是 .
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是 , 每生成l mol Na2FeO4转移mol电子.
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO﹣、OH﹣、FeO42﹣、Cl﹣、H2O.
①写出并配平湿法制高铁酸钾的离子反应方程式: .
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com