
| A. | NH3的空间构型为三角锥形 | |
| B. | 1个二氧化碳分子中存在2个共用电子对 | |
| C. | NaOH和Na2O中所含的化学键类型完全相同 | |
| D. | PCl5和BF3分子中所有原子的最外层都达到8电子稳定结构 |
分析 A、NH3中N原子孤电子对数是1,价层电子对数=3+1=4;
B、二氧化碳分子中碳原子与氧原子分别形成2对共用电子对;
C、NaOH中含有离子键和共价键,Na2O只含有离子键;
D、PCl5中P原子、BF3中B原子都不是8电子稳定结构.
解答 解:A、NH3中N原子孤电子对数是1,价层电子对数=3+1=4,杂化方式为sp3,则NH3的空间构型为三角锥形,故A正确;
B、二氧化碳分子中碳原子与氧原子分别形成2对共用电子对,则1个二氧化碳分子中存在4个共用电子对,故B错误;
C、NaOH中含有离子键和共价键,Na2O只含有离子键,故C错误;
D、PCl5中P原子、BF3中B原子都不是8电子稳定结构,Cl、F原子的最外层电子数为8,故D错误.
故选:A.
点评 本题考查微粒空间构型、共用电子对的判断、化学键等,注意对基础知识的理解掌握,难度不大.


科目:高中化学 来源: 题型:解答题
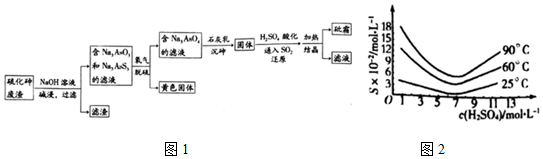
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的△H=+91kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量大于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH,则△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g14CO2含有的中子数为22NA | |
| B. | 标准状况下,22.4LCH3C1含有的分子数为NA | |
| C. | lmol甲醇中含有C-H键的数目为4NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.5 mol•L-1 MgCl2溶液 | B. | 200mL 0.25 mol•L-1 AlCl3溶液 | ||
| C. | 50ml 1 mol•L-1 NaCl溶液 | D. | 25ml 0.25 mol•L-1 CuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 丙烷和2-甲基丙烷的一氯代物均为两种 | |
| C. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| D. | 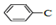 ≡C-COOH是高分子化合物 ≡C-COOH是高分子化合物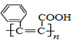 的单体 的单体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com