
| 3×10-20 |
| 3.0 |
| 3×10-20 |
| 3.0 |
| 3×10-20 |
| 1×10-5 |
| 8.0×10-38 |
| (1×10-10)3 |


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
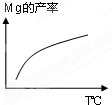 (1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为
(1)可逆反应N2(g)+3H2(g)2NH3(g)是一个放热反应,有甲乙两个完全相同的容器,向甲容器中加入1molN2和3molH2在一定条件下,达到平衡时放出的热量为Q1,相同条件下,向乙容器中加入2molNH3,达到平衡时,吸收的热量为Q2,已知Q2=4Q1,则甲容器中H2的转化率为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 0 | 1 | 2 | 3 |
| N2 | 1.50 | n1 | 1.20 | n3 |
| H2 | 4.50 | 4.20 | 3.60 | n4 |
| NH3 | 0 | 0.20 | n2 | 1.00 |
| A、反应进行到1小时时放出的热量为9.23kJ |
| B、反应3h内,反应速率v(N2)为0.17mol?L-1?h-1 |
| C、此温度下,该反应的平衡常数为0.037 |
| D、4h时,若再加入1molN2,达到新的平衡时,N2的转化率是原来的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 2,3,5,5-四甲基-4,4-二乙基己烷 |
B、 2-甲基-3-丁烯 |
C、 4,7-二甲基-3-乙基壬烷 |
D、 1,3,5-三硝基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
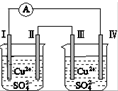
| A、电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ |
| B、电极Ⅰ发生还原反应 |
| C、电极Ⅳ逐渐溶解 |
| D、电极Ⅲ的电极反应:Cu-2e-═Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com