
【题目】下列是元素周期表的一部分,回答下列有关问题:
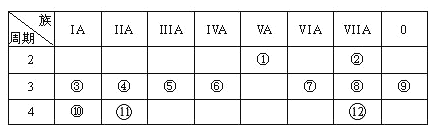
(1)写出元素⑥的元素符号:__________,元素⑦离子的电子式__________。
(2)画出元素④的原子结构示意图:________________________。
(3)在这些元素中,最不活泼的元素是__________(写元素符号)。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是___________,碱性最强的是_____________,呈两性的氢氧化物是_______________。(以上均要求写化学式)
(5)推测50号元素在周期表中的位置:_________________________________。
(6)元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律,试写出一条第三周期元素所形成的化合物某种性质的变化规律:__________________________。
【答案】Si ![]()
 Ar HClO4 KOH Al(OH)3 第五周期 IV A族 随着原子序数的递增,氢化物的稳定性减弱;随着原子序数的递增,最高价氧化物对应的水化物的碱性减弱,酸性增强。
Ar HClO4 KOH Al(OH)3 第五周期 IV A族 随着原子序数的递增,氢化物的稳定性减弱;随着原子序数的递增,最高价氧化物对应的水化物的碱性减弱,酸性增强。
【解析】
由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,为Ca,为Br,然后利用元素及其单质、化合物的性质来解答。
(1)由上述分析可知⑥Si,⑦S,硫离子的电子式为![]() ;
;
(2)④为Mg,原子结构示意图 ;
;
(3)以上元素中Ar的最外层电子数为8,稳定结构,则Ar最不活泼;
(4)非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性最强的是F,次之为Cl,但F物最高价氧化物,则在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4;金属性越强,最高价氧化物对应水化物的碱性越强,金属性最强的是K,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
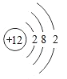
(5)50号元素核外电子排布示意图为 ,电子层数等于周期数,最外层电子数等于主族序数,在周期表中的位置第五周期 IV A族;
,电子层数等于周期数,最外层电子数等于主族序数,在周期表中的位置第五周期 IV A族;
(6)元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律,随着原子序数的递增,氢化物的稳定性减弱;随着原子序数的递增,最高价氧化物对应的水化物的碱性减弱,酸性增强。


科目:高中化学 来源: 题型:
【题目】用标准氢氧化钠溶液(浓度为0.2812mol/L)测定未知浓度的盐酸溶液。
(1)写出化学方程式:____________
(2)滴定时可用_________作指示剂,当溶液由___色变成___色,且0.5min不褪时达到滴定终点。
(3)取20.00mL待测盐酸溶液,滴定终点时,消耗标准氢氧化钠30.00mL,待测盐酸溶液的浓度为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
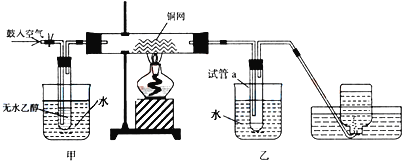
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:___,__。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇的氧化应是__反应。
(3)甲和乙两个水浴作用不相同。甲的作用是__;乙的作用是__。
(4)反应进行一段时间后,试管a中能收集到不同的物质,它们是__。集气瓶中收集到的气体的主要成分是___。(写名称)
(5)若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__。除去该物质,可先在混合液中加入___(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过___(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。下列说法错误的是
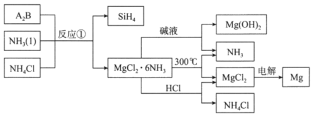
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2·6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物H是一种治疗心血管疾病药物的中间体。一种合成H的路线:
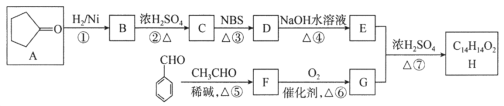
已知:信息① CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
信息② ![]()
回答下列问题:
(1)C的化学名称为________________,D中的官能团名称是__________________。
(2)②的反应类型是______________________________________。
(3)F的结构简式为______________________________________。
(4)写出由E和G生成H的化学方程式:__________________________________________。
(5)芳香族化合物Q是H的同分异构体,一定条件下,H和Q分别与足量H2加成,得到同一种产物,则Q的可能结构有________种(环中没有碳碳叁键,也没有连续的碳碳双键,不考虑立体结构),其中分子内存在碳碳叁键的同分异构体的结构简式为______________。
(6)呋喃丙烯酸(![]() )是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以
)是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以![]() 为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储量丰富成本低的新型电池系统引起了科学家的广泛关注。基于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨(C*y)为负极材料],放电时总反应为:KxC*y+xC(PF6)=C*y+xK++xC+xPF6-,如图所示。下列叙述错误的是( )
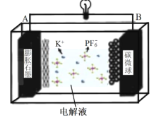
A.放电时,K+在电解质中由A极向B极迁移并嵌入碳微球中
B.充电时,A极的电极反应式为C*y+xK++xe-=KxC*y
C.放电时,每转移0.1NA电子时,电解质增重18.4g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
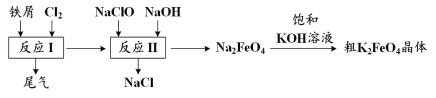
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属有机多孔材料FJI-H14在常温常压下对CO2具有超高的吸附能力,并能高效催化CO2与环氧乙烷衍生物的反应,其工作原理如图所示。下列说法不正确的是( )
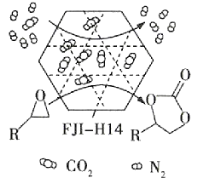
A.该材料的吸附作用具有选择性
B.该方法的广泛使用有助于减少CO2排放
C.在生成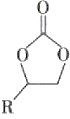 的过程中,有极性共价键形成
的过程中,有极性共价键形成
D.其工作原理只涉及化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com