
 图②
图②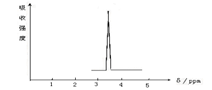
| A.CH3CH3 | B.CH3COOH | C. CH3COOCH3 | D. CH3OCH3 |
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2的代数式表示) CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验测得相关数据如下图1和图2。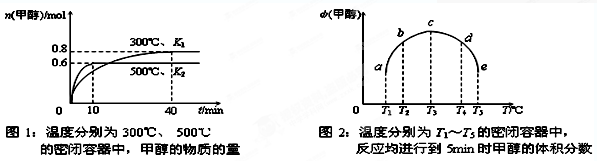
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.升高温度 | B.加入催化剂 | C.将XQ3及时分离出去 | D.增大反应体系的压强 |
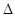 H=-393.5kJ/mol
H=-393.5kJ/mol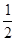 Y2(g)=WY2(g);
Y2(g)=WY2(g);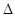 H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。
H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是| A.①② | B.④ | C.③ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测定中和反应的反应热时,大小两烧杯间填满碎纸的作用是固定小烧杯 |
| B.若用50mL 0.55mo1·L—1的氢氧化钠溶液,分别与50mL 0.50mo1·L—1的盐酸和50mL 0.50mo1·L—1的硫酸充分反应,两反应测定的中和反应的反应热不相等 |
| C.在中和滴定实验中,滴定管用蒸馏水洗涤后,然后用标准液润洗,再加进标准液 |
| D.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
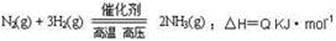
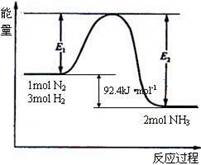
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
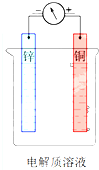
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
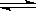 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1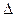 H2=" —771.1" kJ·mol-1
H2=" —771.1" kJ·mol-1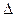 H3=" 482.2" kJ·mol-1
H3=" 482.2" kJ·mol-1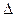 H= kJ·mol-1。
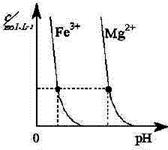
H= kJ·mol-1。 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。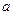 的代数式表示NH3·H2O的电离常数Kb= 。
的代数式表示NH3·H2O的电离常数Kb= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.4.0g碳化硅晶体中所含C—Si数为0.4NA |
| B.PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构 |
| C.电解精炼铜时,当阳极质量减少3.2 g时,电路中转移的电子数为0.1NA |
D.若H+(aq) + OH-(aq)= H2O(l);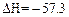 kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com