
 如图是实验室中制备气体或验证气体性质的装置图.回答下列问题:
如图是实验室中制备气体或验证气体性质的装置图.回答下列问题:分析 (1)①二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水;依据方程式中氯元素化合价变化判断做还原剂的盐酸的物质的量;
②氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(2)先验证二氧化硫后验证二氧化碳,二氧化硫具有漂白性,要先在B装置中放入品红溶液验证二氧化硫;由于二氧化硫也能与石灰水反应产生沉淀会干扰二氧化碳的验证,所以在验证二氧化碳之前要保证把二氧化硫除去,这样就需要在C装置中放入酸性高锰酸钾溶液,D中装入品红溶液,检验二氧化硫是否除尽,最后用澄清石灰水检验二氧化碳的存在.
解答 解:(1)①二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,依据方程式可知:当有4mol氯化氢参加反应时,有2mol表现酸性,2mol表现还原性,所以当6mol的HCl参加反应则被氧化的HCl为3,mol;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;3;
②氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(2)①二氧化硫具有漂泊性,能够使品红溶液褪色,据此检验二氧化硫的存在;
故答案为:B;
②证明SO2具有还原性装置为C,现象C中紫色KMnO4溶液褪色或变浅;
故答案为:C中紫色KMnO4溶液褪色或变浅;
③证明生成气体中含有CO2的现象是:D中品红不褪色且E中石灰水变浑浊;
故答案为:D中品红不褪色且E中石灰水变浑浊;
④为排除二氧化硫对二氧化碳检验的干扰,应在D中加入品红溶液,检验SO2是否除尽;
故答案为:检验SO2是否除尽.
点评 本题考查了氯气的制备、二氧化硫、二氧化碳的检验,熟悉装置的特点及各物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应生成2 mol H2O的反应热△H=-2×57.3 kJ/mol | |
| B. | 已知S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395.7 kJ/mol,则硫磺的燃烧热为395.7 kJ/mol | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则金刚石比石墨稳定 | |
| D. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则H2的燃烧热为285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,SiO2和Si都是制造半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明H2SiO3的酸性强于H2CO3 | |
| D. | Na2SiO3溶液中加入盐酸可制备硅酸胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H>0,△S>0 | |
| B. | 用pH均为12的NaOH溶液和氨水分别中和等物质的量的HCl,消耗氨水的v更大 | |
| C. | N2(g)+3H2(g)?2NH3(g) (△H<0),当其他条件不变时,升高温度,H2的反应速率增大、转化率减小 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 途径①反应中体现了浓硝酸的强氧化性和酸性 | |
| B. | 途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率 | |
| C. | 由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子 | |
| D. | 途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| B. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| C. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L.反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| D. |  某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 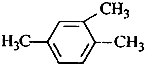 1,3,4-三甲苯 1,3,4-三甲苯 | |
| B. | 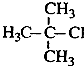 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | |
| C. | 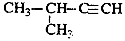 2-甲基-3-丁炔 2-甲基-3-丁炔 | |
| D. | CH3CH2C(CH3)2CH(C2H5)CH3 3,3,4-三甲基已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的H2SO4为0.2mol | B. | 参加反应的NaOH约为0.27mol | ||
| C. | 加入铝粉的质量为5.4g | D. | 与硫酸反应的铝粉的质量7.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com