
【题目】ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
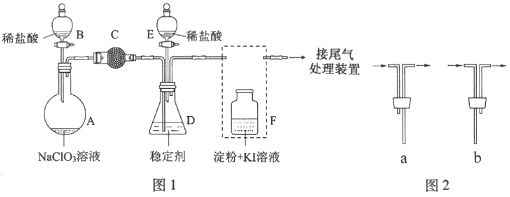
(1)仪器D的名称是___________,安装F中导管时,应选用图2中的___________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜___________(填“快”或“慢”).
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是___________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是___________。
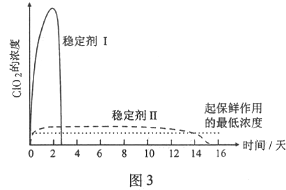
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是___________,原因是___________。
【答案】
(1)锥形瓶;b;
(2)慢;
(3)吸收Cl2;
(4)4H++5ClO2-=Cl-+4ClO2↑+2H2O;验证是否有ClO2 生成;
(5)稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度
【解析】
试题分析:(1)根据仪器特征,可知仪器D是锥形瓶;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,故答案为:锥形瓶;b;
(2)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,故答案为:慢;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,故答案为:稳定剂Ⅱ;稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,有可逆反应:2A(g)+2B(g)![]() C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。

关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同
D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化石能源的大量开采以及污染的加剧,污染气体的治理和开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成;
SO2(g) + I2(g) + 2H2O(g) = 2HI(g) + H2SO4(l) H=a kJ/mol ①
2H2SO4(l) = 2H2O(g) + 2SO2(g) + O2(g) H= b kJ/mol ②
2HI(g) = H2(g) + I2(g) H= c kJ/mol ③
则2H2O(g) = 2H2(g) + O2(g) H= kJ/mol
(2)CO2 和CH4 是两种重要的温室气体,以表面覆盖有Cu2Al2O4 的二氧化钛为催化剂。可以将CO2 和CH4直接转化为乙酸。
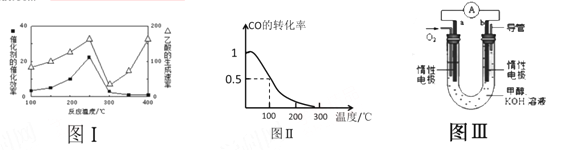
①不同温度下催化剂的催化效率与乙酸的生成速率如图Ⅰ所示,该反应体系应将温度控制在 ℃左右。
②将Cu2Al2O4 溶解在稀硝酸中的离子方程式为 。
(3)甲醇(CH3OH)被称为21世纪的新型燃料。在体积为V L的某反应容器中,a mol CO与2a mol H2 在催化剂作用下反应生成甲醇:CO(g) + 2H2(g) ![]() CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
CH3OH(g) ,CO的平衡转化率与温度的关系如图Ⅱ所示:
①该反应是 (填“放热”或“吸热”)反应
②在其他条件不变的情况下,反应容器中再增加amol CO与2amolH2 ,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
③100℃,反应CH3OH(g) ![]() CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
CO(g) + 2H2(g) 的平衡常数为 (用含有a、V的代数表示)。
(4)某实验小组设计了如图III所示的甲醇燃料电池装置。
①该电池工作时,OH- 向 (填“a”或“b”)极移动
②工作一段时间后,测得该溶液的pH减小,该电池负极反应的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。(填序号)
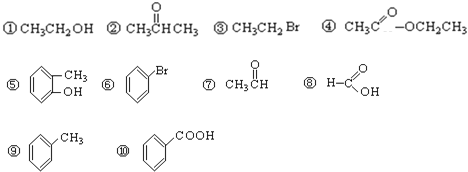
(1)芳香烃:__________; (2)卤代烃:__________;
(3)醇:__________; (4)酚:__________;
(5)醛:__________; (6)酮:__________;
(7)羧酸:__________;(8)酯:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图所示实验。
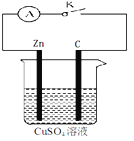
(1)打开K,观察到的现象为 ,
(2)关闭K,观察到的现象是 ,
此电池的负极的电极反应式为 ,
总反应式为 。
(3)关闭K,溶液中阳离子向 (填Zn或C)极运动,
外电路中,电子流动方向是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、氧、磷、铁是与生命活动密切相关的元素。回答下列问题:
(1)P的基态原子最外电子层具有的原子轨道数为 ,Fe3+比Fe2+稳定的原因是 。
(2)N、O、P三种元素第一电离能最大的是 ,电负性最大的是 。
(3)含氮化合物NH4SCN溶液是检验Fe3+的常用试剂,SCN-中C原子的杂化类型为 ,1mol SCN-中含π键的数目为 NA。
(4)某直链多磷酸钠的阴离子呈如图所示的无极单链状结构,其中磷氧四面体通过共有顶角氧原子相连,则该多磷酸钠的化学式为 。
![]()
(5)FeO、NiO的晶体结构均与氯化钠晶体结构相同、其中Fe2+和Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm,则熔点FeO NiO(填“<”、“>”或“=”)原因是 。
(6)磷化硼是一种超硬耐磨的涂层材料,其晶胞结构如图所示。P原子与B原子的最近距离为acm,则磷化硼晶胞的边长为 cm。(用含a的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
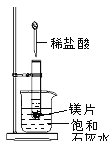
(1)实验中观察到的现象 。
(2)产生该现象的原因 。
(3)写出有关反应的离子反应方程 。
(4)有此推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:下列各项分别与哪个影响化学反应速率因素的关系最为密切?
(1)夏天的食品易变霉,在冬天不易发生该现象 ;
(2)同浓度不同体积的盐酸中放入同样大小的锌块和镁块,产生气体有快有慢 ;
(3)MnO2加入双氧水中放出气泡更快 .
Ⅱ:在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
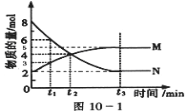
(1)比较t2时刻,正逆反应速率大小V正 V逆.(填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为: .
(3)t3时刻化学反应达到平衡,反应物的转化率为 .
(4)如果升高温度,则V逆 (填增大、减小或不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。请回答下列问题:
,它可通过不同化学反应分别制得B、C、D和E四种物质。请回答下列问题:
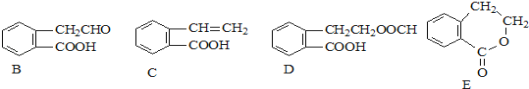
(1)在A~E五种物质中,互为同分异构体的是 (填代号)。
(2)写出由A生成D的化学方程式 。由A生成E的反应类型为 。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(4)C能形成高聚物,该高聚物的结构简式为 。
(5)写出一种区分D和E的试剂 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com