
向50 mL Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51 g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66 g,并有气体产生。
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(2)产生的气体的物质的量为多少?
科目:高中化学 来源: 题型:
亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
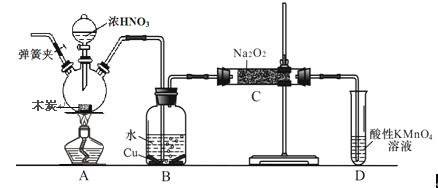

已知:①3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O②酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+;
完成下列填空:
(1)写出a仪器的名称 。
(2)写出NO与过氧化钠在常温下转化成亚硝酸钠的化学反应方程式
(3) B中观察到的主要现象是有无色气体产生和 ,D装置中发生反应的离子方程式为 。
(4)检验C中产物有亚硝酸钠试剂是 。
(5)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(6)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体分子由4个原子构成,其摩尔质量为M g·mol-1。请填写下列空白:
(1)a g该气体的物质的量为________。
(2)b g该气体中所含有的原子总数为________(用NA表示阿伏加德罗常数)。若原子总数为N,则气体的质量为________。
(3)c mol该气体所含原子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将溶质的质量分数为14%的KOH溶液加热蒸发掉100 g水后,得到溶质的质量分数为28%的溶液80 mL,此时溶液的物质的量浓度为( )
A.5 mol·L-1 B.6.25 mol·L-1
C.7 mol·L-1 D.6.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应
C.FeCl3+3KSCN 3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动
3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动
D.对一个可逆反应来说,吸热反应一方的速率受温度变化的影响总是大于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
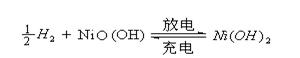 氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是
氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是
根据此反应式判断,下列叙述中正确的是 ( )
A.电池放电时,电池负极周围溶液的PH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,氢气是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
800℃时,在2L密闭容器中发生2NO(g)+O2(g)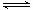 2NO2(g),测得n(NO)随时间的变化如下表:
2NO2(g),测得n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)用O2表示2s时该反应的平均速率v =__________________。
(2)写出该反应的平衡常数表达式:K=__________________________ ___ 。已知:K(800℃)>K(850℃),该反应是__________(填“吸热”或“放热”)反应。
(3)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内气体的密度保持不变
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是_______。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂
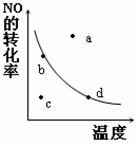
(5)下图中的曲线表示的是其他条件一定时,反应:2NO (g)+O2(g) 2NO2(g)中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 。
2NO2(g)中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 。
A.a点 B.b点
C.c点 D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净
D.欲使Ca2+离子沉淀最完全,选择Na2CO3作沉淀剂效果比Na2SO4好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com