
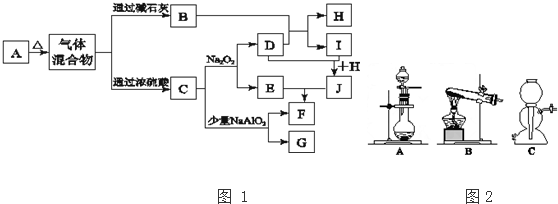
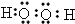 .
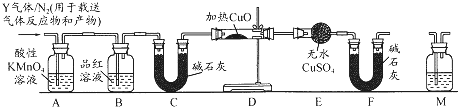
.分析 A加热后的混合气体经浓硫酸后得到C,C可与过氧化钠反应生成无色气体D,则C为CO2,D为O2,E为Na2CO3,混合气体经碱石灰得到B,浓硫酸可以吸收气体B,则B为NH3,与氧气在催化作用下反应生成气体无色I为NO,则H为H2O,由转化关系可知J为HNO3,F为NaHCO3,G为Al(OH)3,若A加热后得到的气体混合物中B和C的物质的量之比为2:1,则A为(NH4)2CO3.
解答 解:A加热后的混合气体经浓硫酸后得到C,C可与过氧化钠反应生成无色气体D,则C为CO2,D为O2,E为Na2CO3,混合气体经碱石灰得到B,浓硫酸可以吸收气体B,则B为NH3,与氧气在催化作用下反应生成气体无色I为NO,则H为H2O,由转化关系可知J为HNO3,F为NaHCO3,G为Al(OH)3,若A加热后得到的气体混合物中B和C的物质的量之比为2:1,则A为(NH4)2CO3.
(1)A的化学式为:(NH4)2CO3,故答案为:(NH4)2CO3;
(2)实验室检验B(氨气)的方法:用蘸浓盐酸的玻璃棒靠近,若出现白烟,证明是NH3 (或用湿润的红色石蕊试纸靠近,若试纸变蓝,证明是NH3 ),
故答案为:用蘸浓盐酸的玻璃棒靠近,若出现白烟,证明是NH3 (或用湿润的红色石蕊试纸靠近,若试纸变蓝,证明是NH3 );
(3)由I生成J的化学方程式:4NO+3O2+2H2 O═4HNO3,
故答案为:4NO+3O2+2H2 O═4HNO3;
(4)C(二氧化碳)和少量NaAlO2 溶液反应生成一种沉淀的和一种酸式盐,其离子方程式:CO2+AlO2 -+2H2 O═Al(OH)3↓+HCO3 -,
故答案为:CO2+AlO2 -+2H2 O═Al(OH)3↓+HCO3 -;
(5)由H(水)所含的两种元素组成的18电子微粒的电子式: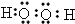 ,
,
故答案为: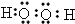 ;
;
(6)若实验室要制备纯净的二氧化碳(可含水蒸气)所需试剂最好选择为稀硫酸与纯碱,由于盐酸、硝酸易挥发,反应不需要加热,碳酸钠为粉末,可用A装置制备,涉及玻璃仪器为分液漏斗、圆底烧瓶,
故答案为:CE;A;分液漏斗、圆底烧瓶.
点评 本题考查无机物的推断,C与过氧化钠反应得到无色气体、气体B能被硫酸吸收等是推断突破口,熟练掌握元素化合物性质,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验 | |
| B. | 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 | |
| C. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 鉴别溶液中是否有SO42-溶液可用盐酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:C2H4 | |
| B. | 铝的原子结构示意图: | |
| C. | H2O的结构式: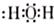 | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯在催化剂作用下能与浓硝酸发生取代反应 | |
| B. | 在一定条件下苯能与氢气发生加成反应 | |
| C. | 在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 | |
| D. | 在苯中加入溴水,振荡后会发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
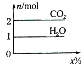 将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将甲,乙两种液体混合,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )| A | B | C | D | |
| 甲 | 戊烯 | 已烯 | 己二炔(C6H6) | 己烷 |
| 乙 | 环己烷(C6H12) | 苯 | 苯 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
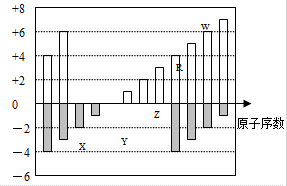
| A. | 单质的氧化性:X>R>W | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一定不能与铜反应 | |
| D. | 离子的氧化性:Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食用盐中滴加少量淀粉溶液,探究食用盐是否含有IO3- | |
| B. | 新制氯水显酸性,将其滴加到紫色石蕊溶液中,充分振荡后溶液最终为无色 | |
| C. | 氯气具有漂白性,可以将湿润的有色布条漂白为无色物质 | |
| D. | 根据较强酸可以制取较弱酸的规律,结合酸性的强弱顺序H2CO3>HClO>HCO3-,可以推出少量的CO2通入NaClO溶液中能生成HClO和碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com