
| A. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| B. | 煤的干馏、煤的汽化和煤的液化都属于化学变化 | |
| C. | 自来水厂用明矾净水,用Fe2(SO4)3或ClO2代替明矾净水,其原理相同 | |
| D. | 将水中的铁闸门连接电源的负极而防腐,是外加电流的阴极保护法 |
分析 A.使用风能、太阳能等清洁能源可以减少二氧化硫、烟尘等有害物质的排放;
B.煤的干馏是将煤隔绝空气加强热使其分解的过程;煤的气化是用煤生产水煤气;煤的液化是用煤生产甲醇;
C.ClO2具有强氧化性,Fe2(SO4)3和明矾没有强氧化性;
D.与外接电源的负极相连,作阴极可以防止被腐蚀.
解答 解:A.化石燃料在燃烧时会释放出二氧化硫、烟尘等有害物质,会污染大气,使用风能、太阳能等清洁能源可以减少二氧化硫、烟尘等有害物质的排放,可减少环境污染,故A正确;
B.煤的干馏是将煤隔绝空气加强热使其分解的过程;煤的气化是用煤生产水煤气;煤的液化是用煤生产甲醇,故煤的干馏、气化和液化均为化学变化,故B正确;
C.ClO2具有强氧化性,能杀菌消毒,Fe2(SO4)3和明矾没有强氧化性,它们在溶液中水解生成胶体,能吸附净水,所以ClO2与Fe2(SO4)3、明矾净水原理不同,故C错误;
D.将水中的铁闸门连接电源的负极,铁闸门作阴极可以防止被腐蚀,该防腐方法是外加电流的阴极保护法,故D正确.
故选C.
点评 本题综合考查了能源、煤的综合应用、净水原理、金属的防腐等,题目难度不大,注意对相关基础的掌握,明确明矾净水与氧化性物质消毒净水的区别、电解原理是解题的关键,侧重于考查学生的分析能力和应用能力.


科目:高中化学 来源: 题型:解答题
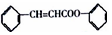 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
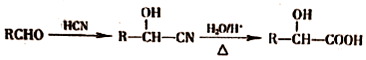
 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (任写一种).
(任写一种).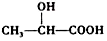 )的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物).
)的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1 mol•L-1(NH4)2SO4溶液与0.2 mol•L-1NH4CI溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | MgSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L水含有的分子数为0.1NA | |
| B. | 12g14C含有的中子数为8NA | |
| C. | 1 L0.1 mol•L-1 FeCl3溶液含阳离子数大于0.1NA | |
| D. | 1molN2和3 mol H2充分反应后,生成气体的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量恰好为9.4kJ时 | D. | 混合气体的压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | 目的 | 装置 | |
| A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 |  |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
| C | 1mol/LNaOH 溶液5mL | 1-氯丁烷5mL | 2%AgNO3 溶液1mL | 证明1-氯丁烷中含有氯元素 | |
| D | 0.1mol/LNaCl 溶液2mL | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S 溶液1mL | 证明AgCl大于Ag2S的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com