
 .
.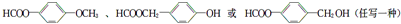 .
.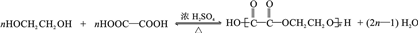 .
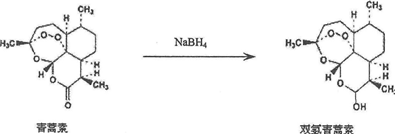
. 分析 I、(1)根据青蒿素的结构简式可知分子中的官能团;
(2)比较青蒿素和双氢青蒿素的结构简式可知,青蒿素中的碳氧双键被还原成了羟基;
(3)双氢青蒿素与甲醇在酸性条件下脱水生成蒿甲醚,根据原子守恒可知蒿甲醚的分子式;
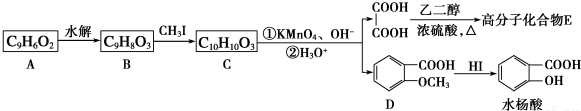
Ⅱ.C被高锰酸钾氧化生成乙二酸和D,结合题给信息及C的分子式知,C的结构简式为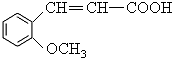 ,B和CH3I发生取代反应生成C,则B的结构简式为:
,B和CH3I发生取代反应生成C,则B的结构简式为: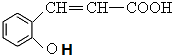 ,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为:
,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为: ,D在HI条件下发生取代反应生成水杨酸,据此答题.
,D在HI条件下发生取代反应生成水杨酸,据此答题.
解答 解:I、(1)根据青蒿素的结构简式可知其分子中的官能团为过氧链、酯基、醚键,
故答案为:酯基、醚键;
(2)比较青蒿素和双氢青蒿素的结构简式可知,青蒿素中的碳氧双键被还原成了羟基,所以青蒿素制备双氢青蒿素的反应为加成反应(还原反应),
故答案为:加成(还原);
(3)双氢青蒿素与甲醇在酸性条件下脱水生成蒿甲醚,根据原子守恒可知蒿甲醚的分子式为C16H26O5,
故答案为:C16H26O5;
Ⅱ.C被高锰酸钾氧化生成乙二酸和D,结合题给信息及C的分子式知,C的结构简式为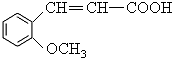 ,B和CH3I发生取代反应生成C,则B的结构简式为:
,B和CH3I发生取代反应生成C,则B的结构简式为: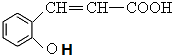 ,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为:
,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为: ,D在HI条件下发生取代反应生成水杨酸,
,D在HI条件下发生取代反应生成水杨酸,
(1)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)由于C→D转化过程发生氧化反应,可以氧化酚羟基,故反应步骤B→C的目的是:B生成C的目的是保护酚羟基,使之不被氧化,
故答案为:保护酚羟基,使之不被氧化;
(3)据ABC的结构简式可知,
a、C中有8种不同环境的氢原子,故a正确;
b、据ABC的结构简式可知,都有碳碳双键,能够发生加聚反应,故b正确;
c、A的结构简式为: ,1molA能够与4mol氢气加成,故c错误;
,1molA能够与4mol氢气加成,故c错误;
d、B中有酚羟基,能够与溴发生取代反应,故d正确;
故答案为:c;
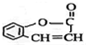
(4)能够水解,说明含有酯基,水解生成的产物之一能发生银镜反应,说明是甲酸酯,其苯的对二取代物有: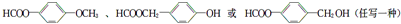 ,
,
故答案为: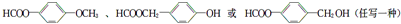 ;
;
(5)乙二酸和乙二醇通过酯化反应合成高分子化合物的化学方程式为: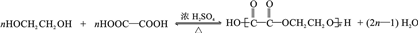 ,
,
故答案为: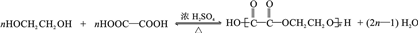 .
.
点评 本题考查有机物推断和合成,难点是推断D的同分异构体,注意水解生成的产物之一能发生银镜反应,说明是甲酸酯,难度较大.


科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 实验现象 | 结论 |
| A | 向NaBr溶液中加入氯水,再加入淀粉KI溶液 | 溶液变蓝 | 氧化性:Cl2>Br2>I2 |
| B | 将铝片放入盐酸中 | 产生气泡的速率开始较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜悬浊液,加热 | 得到蓝色溶液 | 蔗糖水解产物没有还原性 或蔗糖未水解 |
| D | 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 | 品红溶液褪色 | 气体中含有Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
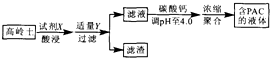 采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16-n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( )
采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16-n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( )| A. | 试剂X为H2SO4 | B. | 滤渣主要成分为Fe(OH)3、H2 SiO3 | ||
| C. | 调pH过高或过低均会减少PAC生成 | D. | 滤液浓缩聚合过程发生了加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
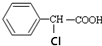 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )| A. | 6种 | B. | 9种 | C. | 15种 | D. | 19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的甲醇、甲醛、甲酸完全燃烧时的耗氧量依次递减 | |
| B. | 在淀粉溶液中加入适量稀硫酸微热一段时间,然后加入过量Na0H中和后,滴加几滴碘水,无明显现象,说明淀粉已经完全水解 | |
| C. | 总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 丙烯酸(CH3=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.8 NA | |
| D. | 此实验条件下,物质的氧化性:NaBiO3>KMnO4>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
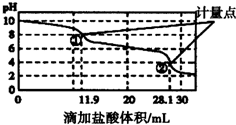
| A. | 此样品n(NaHCO3)=(28.1-11.9)×10-4mol | |
| B. | 计量点②溶液中大量存在的阴离子是Cl- | |
| C. | 计量点①-②之间发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| D. | 使用该方法测定Na2CO3和NaOH混合溶液中的NaOH含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com