
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,两容器含有的
A.分子数和气体质量均不同
B.分子数和电子数均相同
C.质子数和中子数均相同
D.分子数、原子数和中子数均相同
D
【解析】
试题分析:同温同压下,等体积的两容器内气体的分子数相同,所以14N18O、13C18O分子数相同,A、14N18O、13C18O分子数相同,14N18O质量数为32,13C18O质量数为31,气体质量不同,A错误;B、14N18O、13C18O分子数相同,14N18O、13C18O分子含有电子数分别为15、14,所以含有的电子数不同,B错误;C、14N18O、13C18O分子数相同,14N18O、13C18O分子含有质子数数分别为15、14,分子数中中子数都是17,所以含有的质子数不同,中子数相同,C错误;D. 14N18O、13C18O分子都是双原子分子,分子数中中子数都是17,所以原子数目与中子数也相等,D正确;选D。
考点:考查阿伏伽德罗定律及其推论。


科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:填空题
铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
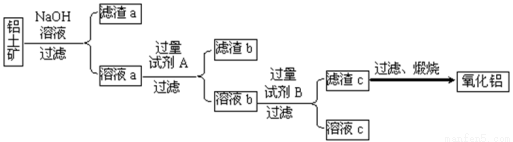
(1)试剂A是 ;
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是 。
Ⅱ.电解熔融的氧化铝可制备金属铝
(3)写出电解的化学方程式 。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(4)①氧化铝高温还原法: Al2O3 + C+ N2 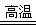 AlN+ CO(配平)
AlN+ CO(配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 AlN+3HCl
AlN+3HCl
(5)方法②比方法①在生产上更具优势。下列说法中,正确的是 。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
科目:高中化学 来源:2015届福建省四地六校高三上学期第一次月考化学试卷(解析版) 题型:选择题
(10分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入盐酸有白色沉淀生成
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断部分A~E物质的化学式:
A ,C 。
(2)D的阳离子的结构示意图是 ;E的阴离子的电子式是 。
(3)写出③、④的离子方程式:
③ ;
④ 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:计算题
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。求
①混合物中Cu的质量
②产生的NO在标准状况下的体积
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:选择题
类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列说法正确的是
A.根据化合价Fe3O4可表示为FeO·Fe2O3 ,则Fe3I8也可表示为FeI2·2FeI3
B.CaC2能水【解析】
CaC2+2H2O―→Ca(OH)2+C2H2↑,则Al4C3也能水【解析】
Al4C3+12H2O―→4Al(OH)3↓+3CH4↑
C.O2与Cu加热反应生成CuO,则S与Cu加热反应生成CuS
D.SO2通入BaCl2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中化学试卷(解析版) 题型:选择题
分类方法在化学学科的发展中起到了非常重要的作用。下图是某反应在密闭容器中反应前后的分子状况示意图,“●”和“○”分别表示不同的原子。对此反应的分类一定不正确的是

A.化合反应
B.氧化还原反应
C.可逆反应
D.置换反应
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
(8分)在一定体积的密闭容器中,进行如下化学反应:
C(s)+ H2O (g)  CO(g)+ H2 (g),其化学平衡常数K和温度t的关系如下表:
CO(g)+ H2 (g),其化学平衡常数K和温度t的关系如下表:

完成下列问题:
(1)该反应的化学平衡常数表达式为K=________________。
(2)能判断该反应是否达到化学平衡状态的依据是__________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(H2)
(3)某温度下,平衡浓度符合下式:c(CO)·c(H2)= c(H2O),试判断此时的温度为___________℃;在此温度下,若反应开始时H2O (g)的浓度为a mol/L,当反应达到平衡时测得CO与H2的浓度均为0.2 mol/L,则反应开始时H2O的浓度a=_______ mol/L。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高二上学期半期联考化学试卷(解析版) 题型:选择题
可用于电动汽车的铝?空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaOH溶液为电解质溶液时,电池在工作过程中电解液的pH保持不变
B.以NaOH溶液为电解质溶液时,负极反应为:Al+3OH--3e-===Al(OH)3↓
C.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为:O2+2H2O+4e-===4OH-
D.电池工作时,电子通过外电路从正极流向负极
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一上学期半期联考化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.虽然石墨有较好的导电性,但它不属于电解质
B.CaCO3、BaSO4都难溶于水,但它们都是电解质
C.实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质
D.酒精(纯净物)在水溶液和熔融状态下均不能导电,所以酒精属于非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com