
某溶液中含有较大量的Cl-、CO32-、OH- 三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是
①滴加Mg(NO3)2溶液; ②过滤; ③滴加AgNO3溶液; ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②①②③ C.④②③②① D.①②③②④
科目:高中化学 来源:2016-2017学年天津市武清区等五区县高三上学期期中考试化学试卷(解析版) 题型:选择题
下列选项中正确的是
A.碳酸钠溶液水解的离子方程式: CO32-+2H2O=H2CO3+2OH-
B.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
C.氢氧化钡在水溶液中的电离方程式:Ba(OH)2=Ba2+ + 2 OH-
D.向含Al(OH)3白色沉淀的溶液中不断通CO2沉淀逐渐溶解
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西桂林市高三上学期期中考化学试卷(解析版) 题型:填空题
化学式为C8H10O的化合物A 具有如下性质:
①A+Na→慢慢产生气泡
②A+RCOOH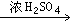 有香味的产物
有香味的产物
③A 苯甲酸
苯甲酸
④催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是( )
a.苯环上直接连有羟基
b.肯定有醇羟基
c.苯环侧链末端有甲基
d.肯定是芳香烃
(2)A和金属钠反应的化学方程式 。
(3)有机物A的同分异构体中,遇FeCl3溶液发生显色反应的共有 种。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西桂林市高三上学期期中考化学试卷(解析版) 题型:选择题
下列实验操作能达到预期实验目的的是 ( )
A.为检验卤代烃中的卤原子,先加入NaOH溶液加热,再滴入AgNO3溶液观察颜色变化
B.为检验醛基的存在,先向试管中加入2 mL 2%的NaOH溶液和数滴CuSO4溶液,再加乙醛,煮沸
C.为制取乙酸乙酯,将稀H2SO4和乙醇、乙酸混合加热,放出的蒸气通入盛有Na2CO3溶液的试管中
D.为制取乙烯,将稀H2SO4和乙醇混合加热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:填空题
回答下列问题:
(1)标准状况下11.2L NH3中含_________个氨分子, mol氢原子。
(2)等质量的SO2和SO3物质的量之比是 ;所含的氧原子个数之比是 。
(3)4.8gC H4中所含氢原子数与 g水所含氢原子数相等。
H4中所含氢原子数与 g水所含氢原子数相等。
(4)含0.4mol A13+的Al2(SO4)3中所含的SO42﹣的物质的量是__________。
(5)已知16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为________。
(6)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是__________。
(7)某盐混合溶液中含有离子:Na+、Mg2+、Cl﹣、SO42﹣,测得Na+、Mg2+ 和Cl﹣的物质的量浓度依次为:0.2mol•L﹣1、0.25mol•L﹣1、0.4mol•L﹣1,则c(SO42﹣)=________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:选择题
在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体能被 磁铁吸引,则反应后溶液中大量存在的阳离子是
磁铁吸引,则反应后溶液中大量存在的阳离子是
A.Fe2+ B.H+ C.Cu2+和Fe 2+ D.Fe3+和Cu2+
2+ D.Fe3+和Cu2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:选择题
在下列反应中,水既不是氧化剂,又不是还原剂的是
A.2Na+2H2O=2NaOH+H2↑ B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2 D.3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
查看答案和解析>>
科目:高中化学 来源:2017届河南省豫北推荐高三上学期精英对抗赛化学试卷(解析版) 题型:填空题
氮氧化物是目前造成大气污染的主要气体。NO在空气中存在如下反应:

(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变
△H2用含△H、△H1的式子来表示):
①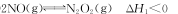
②________。
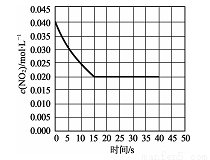
(2)在某温度下的一密闭容器中充人一定量的N02发生上述反应,测得NO2的浓度随时间的变化曲线如下图所示,前5秒内O2的平均生成速率为 mol.L-1.s-l,该条件下反应:2NO+O2 2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g)
2NO2的化学平衡常数数值为 ,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:2NO(g)+O2 (g) 2NO2 (g)△H (填“>”或“<”)0。
2NO2 (g)△H (填“>”或“<”)0。
(3)2NO(g)+O2(g) 2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g)
2NO2 (g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g)+O2 (g) 2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g)
2NO2 (g)反应速率的是反应________(填“①”或“②”);对(2)中反应体系升高温度的过程中,发现2NO(g)+O2 (g) 2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
2NO2 (g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因: (反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
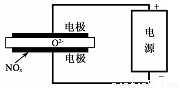
(5)电解法处理氮氧化物是目前大气污染治理的一个新思路。其原理是将NO.在电解池中分解成无污染的N2和02除去,如图所示,,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-。则电解池阴极的电极反应式为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com