
【题目】0.5mol·L-1CH3COONa溶液和水的pH随温度的变化如图所示,下列分析错误的是
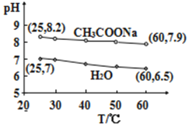
A.25℃,CH3COONa溶液的pH=8.2,显碱性
B.60℃,H2O中c(H+)=1×10-6.5mol·L-1,呈中性
C.60℃,CH3COONa溶液中c(OH-)=1×10-5.1mol·L-1
D.升高温度,CH3COONa溶液水解程度和pH都减小
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】用下图装置进行下列实验,试管内试剂可按需要更换,实验不产生污染性气体且能成功的是 ( )

A.加热NaHCO3制CO2,并用澄清石灰水检验CO2
B.用Cu与浓硫酸反应制少量SO2,并检验SO2的漂白性
C.加热NH4Cl制NH3,并检验氨气溶于水后显碱性
D.用醋酸与乙醇、浓硫酸混合反应制乙酸乙酯,并观察生成的乙酸乙酯的状态、气味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中关于白铜的记载——云南镍白铜(铜镍合金),曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)Ni2+基态原子的电子排布式为_______;3d能级上的未成对电子数为____。
(2)单质铜及镍都是由 _____键形成的晶体;元素铜与镍的第二电离能分别为:Icu =1958kJmol-1、INi=1753 kJmol-1,Icu >I Ni的原因是 ________________。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验 Ni2+。
2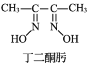 +Ni2+→
+Ni2+→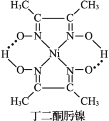 ↓+2H+
↓+2H+
①1 mol 丁二酮肟分子中含有σ 键的数目为_______mol。
②丁二酮肟镍分子中碳原子的杂化轨道类型为_____________。
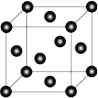
(4)Ni 的晶胞结构如图所示,镍晶体配位数目是__________ ;若 Ni 的原子半径为 d pm,Ni 的密度计算表达式是______g/cm3;Ni 原子空间利用率的计算表达式是_________。(Ni 的相对原子量用 Mr 表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设烷烃的通式为![]() ,以下物理量随n的增加而减小的是 ( )
,以下物理量随n的增加而减小的是 ( )
A. 1mol烷烃中共价键的数目B. 1mol烷烃完全燃烧时的耗氧量
C. 一氯代物的种类D. 氢元素的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于碳碳双键不能自由旋转,因此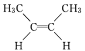 和
和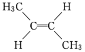 是两种不同的化合物,二者互为顺反异构体。则分子式为C3H4Cl2且含有碳碳双键的同分异构体(含顺反异构)有( )
是两种不同的化合物,二者互为顺反异构体。则分子式为C3H4Cl2且含有碳碳双键的同分异构体(含顺反异构)有( )
A. 7种B. 5种C. 6种D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是
A. 在NaOH水溶液中加热,化合物X可发生消去反应
B. 在一定条件下,1mol化合物Y可消耗4molBr2
C. 用FeCl3溶液可鉴别化合物X和Y
D. 在一定条件,化合物Y可与HCHO发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其它无机原料合成环状化合物E,请在下列图信回答下列问题:

(1)写出①的反应类型______,②所需添加的试剂和反应条件_______
(2)B的结构简式______
(3)E与氢氧化钠溶液反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:
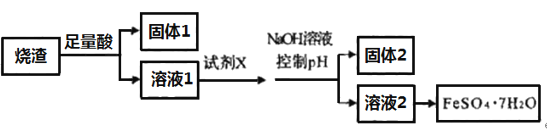
已知:某些金属阳离子可以通过“控制pH”[即调节溶液的酸碱性,pH=-lgc(H+), pH值越大,碱性越强]使其转化为沉淀。固体2为白色沉淀。
(1)加足量酸之后的实验操作是______________________。
(2)溶解烧渣选用的足量酸能否是盐酸,并说明理由___________________________。
(3)验证溶液2中是否含有Fe3+的方法:_______________________________________。
(4)试剂X的作用是_________________。
(5)从溶液2中得到绿矾的操作步骤为:______________、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________________。(此空填序号)
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com