
【题目】能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)己知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),△H=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g), △H=-566.0kJ/mol
③H2O(g)=H2O(l), △H=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式__________________。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。
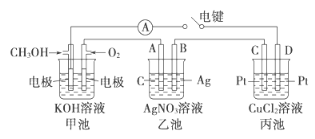
①甲池负极的电极反应为__________________。
②工作一段时间后,测得甲中溶液的pH减小,该电池总反应的离子方程式为______。
③乙池中A(石墨)电极的名称为__________________(填“正极”、“负极”或“阴极”、“阳极”),乙池中总反应式为_________。
④当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为__mL(标准状况),假设乙池、丙池中的溶液均为足量,丙池中____(填“C”或“D”)极析出______g铜。
【答案】CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/molCH3OH-6e-+8OH-=CO32-+6H2O2CH3OH+3O2+4OH-=2CO32-+6H2O阳极4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3280D1.6
4Ag+O2↑+4HNO3280D1.6
【解析】
(1)己知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0 kJ/mol
则根据盖斯定律可知(①-②+4×③)/2即得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol。
(2)①甲池为原电池,燃料在负极失电子发生氧化还原反应,在碱溶液中生成碳酸盐,甲池中通入CH3OH的电极反应为CH3OH-6e-+8OH-=CO32-+6H2O;
②根据以上分析可知甲池是燃料电池,由于电解质溶液显碱性,则生成物是碳酸钾和水,所以工作一段时间后甲中溶液的pH减小,因此该电池总反应的离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O;
③乙池是电解池,A电极与电源的正极相连,则A为阳极,B为阴极,电池中是电解硝酸银溶液生成银,硝酸和氧气,电池反应为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
④乙池中B极质量增加5.4g为Ag,物质的量为5.4g÷108g/mol=0.05mol,依据电子守恒计算4Ag~O2~4e-,甲池中理论上消耗O2的物质的量是0.05mol÷4=0.0125mol,在标准状况下的体积为0.0125mol×22.4L/mol=0.28L=280mL;丙为电解池C为阳极,D为阴极,电解氯化铜溶液铜离子在阴极得到电子析出铜,结合电子守恒计算2Ag~Cu~2e-,析出铜的物质的量是0.05mol÷2=0.025mol,质量为0.025mol×64g/mol=1.6g。


科目:高中化学 来源: 题型:
【题目】溴螨酯是一种杀螨剂。由某种苯的同系物制备溴螨酯的一种合成路线如下( 部分反应条件和试剂略):
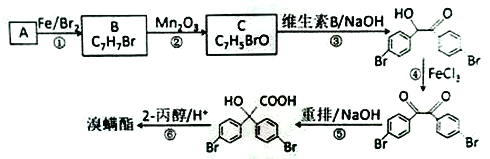
回答下列问题:
(1)A的名称是________,B 的结构简式是_______。
(2)C能发生银镜反应,其分子中含氧官能团的名称是_______。
(3)写出第3 步反应的化学方程式:________。
(4)第①、④步的反应类型分别是_______、_______。
(5)M为 的同分异构体,其核磁共振氢谱显示有4 种不同化学环境的氢,且数目比为4:4:1:1,M的结构简式为____________。
的同分异构体,其核磁共振氢谱显示有4 种不同化学环境的氢,且数目比为4:4:1:1,M的结构简式为____________。
(6)写出用乙醛为原料制备2-羟基-2-甲基丙酸乙酯的合成路线( 其它试剂任选):________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 浓硫酸溶于水是放热反应
C. 反应物和生成物所具有的总能量决定了放热还是吸热
D. 断开化学键放热,形成化学键吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用托盘天平称取1.06gNa2CO3固体
B.用10mL量筒量取8.58mL蒸馏水
C.用稀盐酸洗净做焰色反应的铁丝
D.为了加快过滤的速率,用玻璃搅拌过滤器中的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如右图所示。下列有关说法正确的是

A. 常温下,PbI2的Ksp为2×10-6
B. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳碳双键有如下所示的断裂方式:
 ;
;
 。
。
高分子单体A(C6H10O3)可进行如下反应(反应框图)

已知:
Ⅰ.对框图中某些化合物性质的说明:A在室温下不与NaHCO3溶液反应,但可与Na反应放出H2;B可与NaHCO3溶液反应放出CO2;C可与Na反应放出H2而D不能;G在室温下既不与NaHCO3溶液反应,也不与Na反应放出H2。
Ⅱ.两个一OH连在同一个C原子上的结构不稳定。
(1)写出反应①中(1)的反应类型:___________;写出D的键线式:____________________。
(2)写出物质E所含官能团的名称: ____________________。
(3)B在浓H2SO4存在下与甲醇共热反应生成的有机物的系统名称为____________________。
(4)写出F→G的化学反应方程式:____________________________________。
(5)与B互为同分异构体,分子为链状的酯类物质共有______________种(不考虑立体异构)。
(6)请设计合理方案,用物质E制备乙二酸(其他原料自选,用反应流程图表示,并注明必要的反应条件) ______________。例如:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:
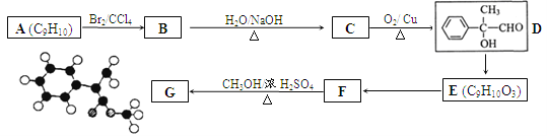
试回答:
(1)G的分子式为 ____________。
(2)A的结构简式为 ___________;D中官能团的名称为 __________。
(3)B→C反应的化学方程式是 ____________________________。
(4)E的同分异构体中可用通式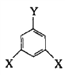 表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com