
【题目】下列说法正确的是( )
A.酯化反应、硝化反应、水解反应均属于取代反应
B.由乙醇生成乙烯的反应与乙烯生成溴乙烷的反应类型相同
C.石油的裂解是化学变化,而石油的分馏和煤的气化是物理变化
D.蛋白质、糖类、油脂均是能发生水解反应的天然高分子化合物
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存的无色离子组是
A. K+、Mg2+、Cl-、MnO4- B. Na+、Al3+、CO32-、NO3-
C. Fe3+、Na+、SO、SCN- D. Na+、Mg2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下有两份体积相同的CO2和O3,关于它们的叙述正确的是( )
A. 分子数之比是1∶1 B. 原子个数比是3∶2
C. 质量比是 1∶1 D. 密度之比是1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
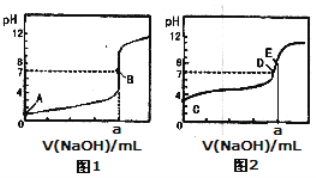
以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B为第VA族相邻的两种元素,其所在周期分别最多可排18和8种元素,当A的原子序数 为x时,B的原子序数为
A. x+8 B. x-8 C. x+18 D. x -18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层轨道表达式_________;D元素原子的价电子排布式是___________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为_____, B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是______;C、D和E的电负性由大到小的顺序为______;C、D和E的第一电离能由大到小的顺序是______;C和D最高价含氧酸的酸性由弱到强的顺序为_________。CO![]() 中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_________,该离子的配位体为____________。
(4)D(黑球)和F(白球)形成的某种晶体的晶胞如图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3,(列出计算式即可,不必计算结果,阿伏加德罗常数值为NA),最近的黑球和白球之间的距离为____________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬渣含有Na2SO4及少量Cr2O72-、Fe2+。从化工厂铬渣中提取硫酸钠的工艺如下:

已知:常温时,Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”的作用是__________________。(填写两点);滤渣A为_____(填化学式)。
(2)根据溶解度(S)-温度(T)曲线,操作B为___________。

(3)酸C为_________(填化学式),“酸化、还原”步骤反应的离子方程式为__________。
(4)常温时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=_______。
(5)某工厂采用电解法处理含铬废水,用铁作阴阳极,槽中盛放含铬废水,原理示意图如下。

阴极放出氢气,阳极区发生的反应有_________,___________。不考虑气体的溶解,当收集到6.72L(标准状况)的氢气时,理论上有________molCr2O72-被还原。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com