
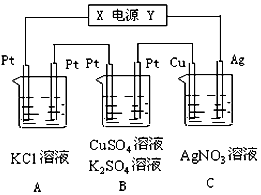
分析 (1)由C池连接电源,则为电解池,反应5min,银电极质量增加2.16g,则Ag电极为阴极,Cu极为阳极失电子发生氧化反应,根据得失电子守恒计算;
(2)根据电极反应及电子守恒来计算;
(3)根据A中A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑~2e-及与C中转移的电子守恒来计算.
解答 解:(1)由C池连接电源,则为电解池,反应5min,银电极质量增加2.16g,则Ag电极为阴极,发生Ag++e-═Ag,则Cu电极为阳极,反应式为:Cu-2e-=Cu2+,所以根据得失电子守恒,Cu电极质量减轻$\frac{2.16g}{108g/mol}$×$\frac{1}{2}$×64g/mol=0.64g,故答案为:电解池;Cu-2e-=Cu2+;0.64;
(2)C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,
B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案为:4OH--4e-═2H2O+O2↑;0.025 mol•L-1;
(3)由A中发生2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑~2e-,
由电子守恒可知,转移0.02mol电子时生成0.02molKOH,忽略溶液体积的变化,
则c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol•L-1,溶液pH=13,
故答案为:13.
点评 本题考查电解原理,明确Ag电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:多选题
| 选项 | 需除杂的物质 | 试剂 |
| A | Fe(Al) | NaOH溶液 |
| B | CO2(HCl) | NaOH溶液 |
| C | NaCl(Na2CO3) | 稀硫酸 |
| D | NH3(H2O) | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、分液漏斗使用前都必须检查是否漏水 | |
| B. | 用98%的浓硫酸配制100 g 10%的稀硫酸时,除使用量筒外还需用到容量瓶 | |
| C. | 在钠跟水反应的实验中,切下绿豆粒大小的钠投入水中进行实验,剩余的钠块丢弃到废料桶中 | |
| D. | 配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所配溶液的浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AIO2- | B. | Fe2+ | C. | Fe3+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
| A. | -1928 | B. | +1928 | C. | +1838 | D. | -1838 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、HS-NO3- | B. | Al3+、Cl-、HCO3-、Na+ | ||
| C. | AlO2-、K+、CO32-、Na+ | D. | Fe2+、K+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | F2和Cl2 | B. | F2和Br2 | C. | Cl2和Br2 | D. | Br2和I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com