
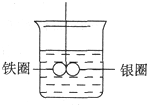
 如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.
如图所示,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.分析 (1)铁圈和银圈连接浸入硫酸铜溶液中,该装置构成了原电池,铁较活泼的金属作负极,银较不活泼的金属作正极,根据正负极上发生的电极反应判断反应现象;(2)铁、银、硫酸铜构成原电池,铁不断失电子而减少,银上不断析出铜,质量增加;
(3)银圈是正极,电极上发生的反应式为:Cu2++2e-=Cu;
(4)甲醇燃料电池放电时,C元素的化合价升高,所以甲醇所在电极为原电池的负极,O元素的化合价降低,所以通入氧气的极为原电池的正极,负极上发生氧化反应,正极上发生还原反应,以此来解答.
解答 解:(1)依据金属活动顺序可知铁的活泼性强于银,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液后,该装置构成了原电池,铁较活泼的金属作负极,失去电子,发生氧化反应生成铁离子,质量减小;银较不活泼的金属作正极,铜离子在正极得到电子发生还原反应生成铜,在银圈上析出,所以铁圈向上倾斜,银圈向下倾斜,
故选D;
(2)产生上述现象的原因是:铁、银、硫酸铜构成原电池,铁不断失电子而减少,银上不断析出铜,质量增加,所以银圈逐渐向下倾斜;
故答案为:铁、银、硫酸铜构成原电池,铁不断失电子而减少,银上不断析出铜,质量增加,所以银圈逐渐向下倾斜;
(3)银圈是正极,电极上发生的反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(4)CH3OH和O2在电池中,肯定是O2氧化CH3OH,CH3OH是负极反应物,O2是正极反应物.CH3OH被氧化生成CO2和H2O,电解质溶液中有强碱(OH-),CO2要转化CO32-,甲醇是负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,CH3OH被氧化生成CO2和H2O,电解质溶液中有强碱(OH-),则CO2要转化CO32-,电池反应为:2CH3OH+3O2+4OH-═2CO32-+6H2O,故答案为:负;CH3OH+8OH--6e-═CO32-+6H2O;2CH3OH+3O2+4OH-═2CO32-+6H2O.
点评 本题考查了电解池工作的原理,明确铁和银的活泼性强弱顺序,原电池工作的原理是解题的关键.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸跟氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 硝酸跟碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| C. | 氯化钠溶液跟硝酸银溶液反应:Ag++Cl-═AgCl↓ | |
| D. | 盐酸跟氢氧化铜反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项目 | 实验目的 | 实验方案 |
| A | 验证稀硫酸和稀硝酸的氧化性强弱 | 将两块相同的铜片分别加入浓度均为2mol/L的硫酸和硝酸中,观察反应的难易程度 |
| B | 验证Cu、Fe的还原性强弱 | 将铁丝和铜丝分别插入浓硝酸中,观察反应的剧烈程度 |
| C | 验证Br、I非金属性强弱 | 将少量溴水加入KI-淀粉溶液中,观察溶液是否变蓝色 |
| D | 验证Mg、Al的金属性强弱 | 将两片完全相同的Mg、Al分别投入到稀盐酸中,观察产生气泡的快慢程度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 | |
| C. | NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) | |
| D. | 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
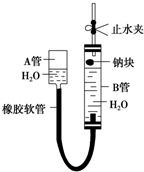 如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:
如图是某化学学习小组用来探究钠与水反应的实验装置.该装置可以集反应、收集、检验气体于一体.图中钠块是用大头针叉住的.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用长颈漏斗可分离出乙酸与乙醇反应的产物 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | C4H9Cl有3种同分异构体 | |
| D. | 油脂和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: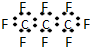 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子中既有极性键又有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:5 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com