
���� ��1�����ݸ�˹���������������ȫȼ�յķ�Ӧ�ȣ�
��2��������ƽ����������ȡ������������ɴ�������һЩ����������
�ڸ���CO��ת���ʼ���CO��Ũ�ȱ仯������������ʽ�������ֵ�Ũ�ȱ仯����ƽ��ʱ����ֵ�Ũ�ȣ���ƽ��Ũ�ȴ���ƽ�ⳣ������ʽ����÷�Ӧ��ƽ�ⳣ����
��� �⣺��1���ɢ�2C3H8��g��+7O2 ��g��=6CO ��g��+8H2O��l����H1=-2741.8kJ/mol��
��2CO ��g��+O2��g��=2CO2 ��g����H2=-566kJ/mol��
���ݸ�˹���ɿ�֪��$\frac{��+�ڡ���}{2}$�ɵ�C3H8��g��+5O2 ��g��=3CO2 ��g��+4H2O��l�����䷴Ӧ��Ϊ$\frac{��-2741.8kJ/mol��+��-566kJ/mol����3}{2}$=-2219.9KJ/mol��
�ʴ�Ϊ��C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H=-2219.9kJ/mol��
��2����a���ɷ�Ӧ��֪����Ӧǰ���ѹǿʼ�ղ��䣬����ϵ�е�ѹǿ�������仯�������ж�ƽ�⣬��a����
b��v����H2��=v����CO��������Ӧ���ʵ����淴Ӧ���ʣ��ﵽƽ�⣬��b��ȷ��
c����������������䣬�����ʵ����������仯�������ж�ƽ�⣬��c����
d��CO2��Ũ�Ȳ��ٷ����仯����ƽ���������������֪����ѧ��Ӧ�ﵽƽ�⣬��d��ȷ��
�ʴ�Ϊ��bd��
��C3H8�ڲ�������������ȼ�գ�����CO��CO2�Լ���̬ˮ��������ʼ��CO2������Ԫ���غ��֪����ˮΪ2.4mol/L��COΪ1mol/Lʱ��������̼Ϊ0.8mol/L���ﵽƽ���CO��ת����Ϊ60%����CO��Ũ�ȱ仯��=1mol/L��60%=0.6mol/L����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L����1 2.4 0.8 0
�仯��mol/L����0.4 0.4 0.4 0.4
ƽ�⣨mol/L����0.6 2.0 1.2 0.4
ƽ�ⳣ��k=$\frac{1.2��0.4}{0.6��2.0}$=0.4��
�ʴ�Ϊ��0.4��
���� ���⿼�黯ѧƽ����йؼ��㣬��Ŀ�Ѷ��еȣ�ע������Ӱ��ƽ���ƶ������أ�����ƽ��ת���ʵļ����Ӧ�ã��ѵ��ǻ�ѧƽ��״̬���жϣ�Ҫץסƽ��������жϣ����������飮


 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����NaOH��Һ��Ӧ��ͬ���칹�干��6�� | |
| B�� | ���ڷ����к�����Ԫ����ͬ���칹�� | |
| C�� | �Ⱥ����ǻ��ֺ���ȩ������5�� | |
| D�� | �����ں���2���ǻ���ͬ���칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
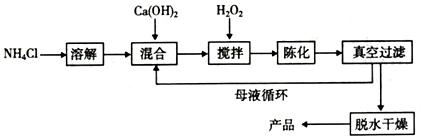
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ�������Ȼ����Һ������������Һ�����ȡ���� | |
| B�� | ��������ʱ�����������������ĵ������� | |
| C�� | ���������ˮ����ѧ�����ȶ������Ȳ��ֽ� | |
| D�� | O2��NO��NO2������Ũ��������ͨ��������ܹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
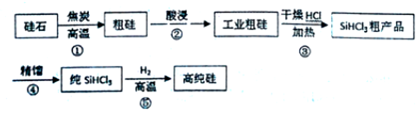
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
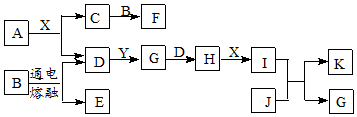
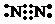
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�����ʵ���Ũ�ȵ���Һ���ƹ����У����Ӷ��ݣ�������Һ��Ũ��ƫ�� | |
| B�� | ��ͬ�������ͬ���ʵ���Ũ�ȵIJ�ͬ��Һ���������ʵ����ʵ�����ͬ | |
| C�� | ��Һ��������������Ϊw���ܶ�Ϊ�� g/cm3������Ħ������ΪM g/mol����Һ�����ʵ���Ũ��Ϊ$\frac{pw}{M}$mol/L | |
| D�� | 10 mol/L��Ũ������H2O������������û��Һ��Ũ��Ϊ5 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com