
【题目】下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 ![]()
![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解→说明试样已变质
沉淀不溶解→说明试样已变质
B.除去粗盐中含有的硫酸钙杂质:粗盐 ![]()
![]()
![]()
![]()
![]()
![]() 精盐
精盐
C.检验某溶液中是否含有Fe2+:试样 ![]() 溶液颜色无变化
溶液颜色无变化 ![]() 溶液变红色→溶液中含有Fe2+
溶液变红色→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液 ![]()
![]() 溶液变紫色→氧化性:H2O2>I2
溶液变紫色→氧化性:H2O2>I2
【答案】C
【解析】解:A.若变质生成硫酸钠,应先加盐酸,排除亚硫酸根离子的干扰,再加氯化钡检验硫酸钠的存在,故A错误;
B.应先加氯化钡,再加碳酸钠,然后过滤后再加盐酸可实现除杂,选项B中钡离子不能除去,故B错误;
C.亚铁离子遇KSCN溶液不变色,滴加氯水后亚铁离子被氧化生成铁离子遇KSCN溶液变色,可证明溶液中含有Fe2+ , 故C正确;
D.硝酸具有强氧化性,可氧化碘离子,不能说明H2O2的氧化性比I2强,应选盐酸,故D错误;
故选C.
A.硝酸具有强氧化性,能氧化亚硫酸钡生成硫酸钡沉淀;
B.应先加氯化钡,再加碳酸钠;
C.亚铁离子遇KSCN溶液不变色,亚铁离子被氧化生成铁离子遇KSCN溶液变色;
D.硝酸具有强氧化性,可氧化碘离子.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
【题目】如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。

(1)图中属于烷烃的是_________;属于烯烃的是_______(填字母)。
(2)上图中互为同分异构体的是A与____; B与______;D与____(填字母)。
(3)C的化学式为____________;其一氯代物的同分异构体有___种。
(4)写出B与氯化氢反应的化学反应方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A. Na2CO3溶液与足量盐酸反应:CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
B. FeCl2溶液和Cl2反应:2Fe2++Cl2===2Fe3++2Cl-
C. 钠与水反应:Na+H2O===Na++OH-+H2↑
D. NaHCO3溶液与稀硝酸反应:HCO![]() +H+===CO2↑+H2O
+H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol任何物质都含有约6.02×1023个原子
B.常温下,22.4LSO2所含的分子数为NA
C.摩尔是物质的量的单位
D.H2O 的摩尔质量是18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.
(1)C离子的结构示意图为_______.D在周期表中________位置.
(2)A、D两元素形成的化合物属________(填“离子”或“共价”)化合物..
(3)写出E的电子式:________..
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是元素周期表的一部分,A、B、C、D、E、F、G、X分别代表一种元素,其中X在周期表中的位置没有标出,请回答下列有关问题。

(1)X在A元素附近,与F能形成化学式为XF的离子化合物,X单质的密度小于水,有两种重要的氧化物。X在周期表中的位置是第______周期第______族;X单质与其相邻元素的单质形成的合金主要用途是_____________________。
(2)A、C具有相似的化学性质,请写出A和X的最高价氧化物对应的水化物之间反应的离子方程式______________________。
(3)B与水蒸气在高温下反应的化学方程式是_______________。
(4)E的一种氧化物通入F的水溶液中可以得到两种物质,写出反应的离子方程式:______________________________________________________。
(5)有同学判断G是一种稀有气体,由此判断不存在G的化合物。该说法是否正确:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
请回答下列问题:
(1)X2分子中σ键和π键数目比是 .
(2)R的晶胞结构如图所示,该晶胞中所含的原子个数是 . 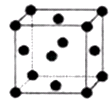
(3)下列有关X、Y、W的说法正确的是 .
①X的第一电离能在同族元素中最小
②常温下,Y的氢化物分子间存在氢键
③XY3﹣中X的杂化轨道类型为sp3杂化
④W属于d区的元素
(4)将X的气态氢化物的水溶液滴入R的氢氧化物悬浊液中,可得深蓝色溶液,该反应的离子方程是 .
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 .
(6)与X3﹣互为等电子体的分子有、离子有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用低品位软锰矿浆(主要成分是MnO2,少量的Fe3+、Al3+等)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体可实现资源的综合利用和环境治理。
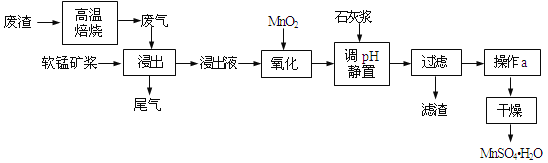
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
Fe2+ | 7.6 | 9.7 | |
Fe3+ | 2.7 | 3.7 | |
Al3+ | 3.8 | 4.7 | >8.5 |
Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式_____________________________。为了提高软锰矿的浸取率,可以采取的措施除了充分搅拌外还有:_____________________(至少答两点)。
(2)写出氧化过程中主要反应的离子方程式:_____________________________。
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______。②若加入的石灰浆过多,会使得MnSO4H2O晶体中含有较多杂质,其原因是_____________________________。
(4)下列各组试剂中,能准确测定尾气中SO2含量的是______(选填序号)。
a.NaOH溶液、品红溶液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com