
科目:高中化学 来源: 题型:
在一定温度下,于10L密闭容器中充入5 mol SO2和3 mol O2,反应达到平衡时,混合气体中SO3的物质的量分数为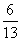 。求(1)此反应在该温度下的平衡常数K (2)平衡时SO2的转化率 (3)平衡时容器内的压强与反应前的压强之比 (最简整数比)
。求(1)此反应在该温度下的平衡常数K (2)平衡时SO2的转化率 (3)平衡时容器内的压强与反应前的压强之比 (最简整数比)
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )

| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | NaOH | NaHSO3 | Na2SO3 | SO2 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | NaOH |
| C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
| D | C | CO | CO2 | O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A、 Na与H2O的反应是熵增的放热反应,该反应能自发进行
B、 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C、 FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D、 Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3 。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:
| |
 ClO3-+
ClO3-+ | |
 Fe2++
Fe2++ | |
 =
= | |
 Cl-+
Cl-+ | |
 Fe3++
Fe3++ | |
 .
. (3)FeCl3 在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
 欲使平衡正向移动可采用的方法是(填序号) 。
欲使平衡正向移动可采用的方法是(填序号) 。
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
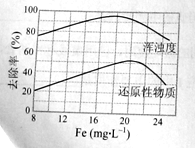
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约
为 mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列制定微粒的数目相等的是
A.等物质的量的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有的共用电子对数
C.同温.同压同体积的CO和NO含有的质子数
D.等物质的量的铁和铝分别于足量氯气完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上,向500—600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行试验。
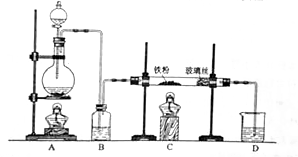
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,装置B中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,装置A用来制取 。尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
(3)若操作不当,制得的FeCl2 会含有少量FeCl3 ,检验FeCl3常用的试剂是 。欲制得纯净的FeCl2 ,在实验操作中应先 ,再 。
选考题(请考生在第18.19.20三题中任选一题作答,如果多做,则按所做的第一题计分.)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程表达式中,属于电离方程式的是
A.HCO3- + H2O 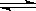 H2CO3 + OH- B.HCO3- + OH- ==== H2O + CO32-
H2CO3 + OH- B.HCO3- + OH- ==== H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O 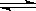 NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com