
| A、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | ||
| B、由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | ||
C、
| ||
| D、c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、HCO3- |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
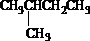
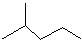
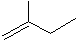
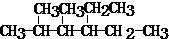
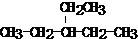
查看答案和解析>>
科目:高中化学 来源: 题型:
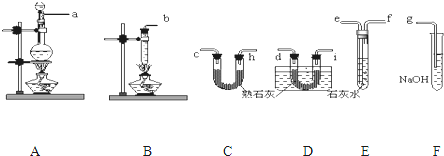
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
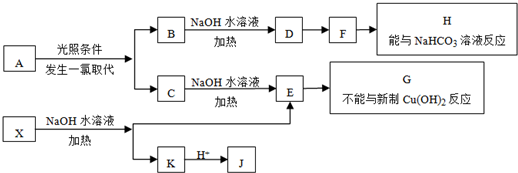
查看答案和解析>>
科目:高中化学 来源: 题型:
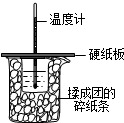 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
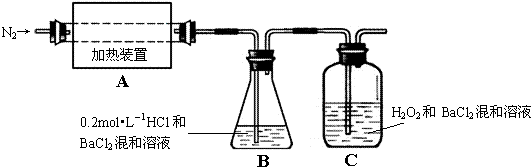
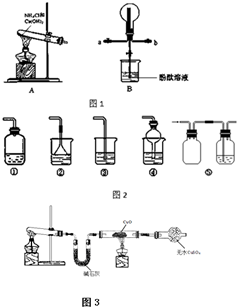 某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).
某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)十c(H2CO3)=c(HCO3-)+2c(CO32-) |
| C、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
| D、等物质的量浓度的硫酸与醋酸钠溶液等体积混合:2c(SO42-)+c(OH-)=c(H+)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com