
| 1 |
| 10 |
| 1 |
| 10 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
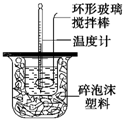 在量热器中将50ml、0.50mol?L-1CH3COOH溶液与50ml、0.55mol?L-1NaOH溶液混合,温度从25.16℃升高到27.46℃.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J?0C-1,C=4.18J?g-1?0C-1,溶液的密度为1g?cm-3.
在量热器中将50ml、0.50mol?L-1CH3COOH溶液与50ml、0.55mol?L-1NaOH溶液混合,温度从25.16℃升高到27.46℃.已知量热计的热容常数(量热计各部件每升高10C所需的热量)是150J?0C-1,C=4.18J?g-1?0C-1,溶液的密度为1g?cm-3.查看答案和解析>>
科目:高中化学 来源: 题型:
 液,试画出原电池的装置图,并说明其工作原理.
液,试画出原电池的装置图,并说明其工作原理.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2S3和 Al(OH)3 |
| B、Fe(OH)3和Al(OH)3 |
| C、FeS、Al(OH)3 和S |
| D、Al2S3、FeS和S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com