
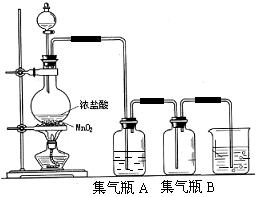
 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O分析 (1)根据氧化还原反应中化合价变化判断氧化剂、氧化产物;单质、氧化物、弱电解质写化学式,强酸、易溶于水的盐写成离子,据此改写化学方程式.
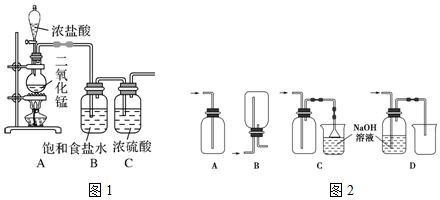
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质,结合氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大,选择除杂试剂;
(3)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气;
解答 解:(1)在4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O中,二氧化锰化合价由+4变为+2,化合价降低被还原,做氧化剂;氯化氢化合价由-1变为0,化合价升高,做还原剂;单质、氧化物、弱电解质写化学式,强酸、易溶于水的盐写成离子,所以二氧化锰和浓盐酸的离子方程式为4H+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O,故答案为:MnO2 HCl; 4H+2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O,
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质,结合氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大,所以可以用盛有饱和食盐水的洗气瓶除去氯气中的氯化氢;
故答案为:除去氯气中的氯化氢;
(3)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气;
故答案为:氢氧化钠溶液.
点评 本题以实验室制备氯气为载体考查了氯气的制备、氧化还原反应基本概念,题目难度不大,掌握基础是关键.


科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
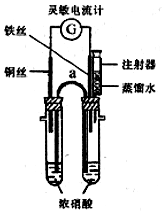 某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.
某化学课外活动小组的同学利用原电池原理探究一定温度下(实验时实际的环境温度)使铁钝化的硝酸的最低浓度.| 实验次数 | 实验温度(℃) | 注入水的体积(mL) |
| 1 | 17.2 | 2.4 |
| 2 | T1 | 2.5 |
| 3 | T2 | 2.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )
某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.下列有关说法不正确的是( )| A. | 反应2min末X的浓度为0.35mol/L | |
| B. | 该反应的化学方程式可表示为:2Z?2Y+3X | |
| C. | 反应2min内以Z浓度变化表示的平均反应速率为0.05mol/(L•min) | |
| D. | 任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率/% | 80 | a1 | a2 | a3 | |
| A. | 该温度下,该反应的平衡常数K为400 | |
| B. | SO2的平衡转化率:a1>a2=a3 | |
| C. | 达到平衡时,容器丁中的正反应速率比容器丙中的大 | |
| D. | 达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com