
| A. | 溶液中水电离出的H+个数:②>① | |
| B. | ①溶液中阴离子的总浓度小于0.01 mol•L-1 | |
| C. | ②溶液中:n(OH-)=n(HCO3-)+2n(H2CO3)+n(H+) | |
| D. | ②溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
分析 A.浓度越稀水解程度越大,所以①水解程度大于②,而水电离出的氢离子和氢氧根离子的物质的量相等,据此判断溶液中水电离出的H+个数;
B.①溶液中碳酸根离子水解生成碳酸氢根离子和氢氧根离子,导致阴离子难度增大;
C.根据碳酸钠溶液中的质子守恒判断;
D.水解是微弱的,所以离子浓度大小关系是c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3).
解答 解:A.离子浓度越稀水解程度越大,所以①水解程度大于②,而水电离出的氢离子和氢氧根离子的物质的量相等,所以溶液中水电离出的H+个数:①>②,故A错误;
B.①溶液中,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,导致阴离子的浓度增大,即:阴离子的总浓度大于0.01 mol•L-1,故B错误;
C.根据碳酸钠溶液中的质子守恒可知:n(OH-)=n(HCO3-)+2n(H2CO3)+n(H+),故C正确;
D.水解是微弱的,所以离子浓度大小关系是c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3),故D错误;
故选C.
点评 本题考查离子浓度大小的比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
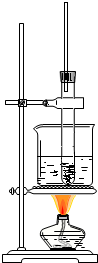 硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:
硝基苯是制造染料的重要原料.某同学在实验室里用右图装置制取硝基苯,主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式:Al-3e-+3H2O=Al(OH)3+3H+ | |
| B. | 放电过程中,Cl-向正极移动 | |
| C. | 每转移0.2mol电子,理论上生成0.1molH2S气体 | |
| D. | 处理过程中银器一直保持恒重 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电负性 离子半径 键的极性 | 熔点 |
| N<O O2->Al3+ C-H<H-O | Al<Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
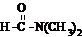 溶于水
溶于水 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com