
| A. | K22=$\frac{1}{{k}_{1}}$ | B. | K1=K2 | C. | K12=K2 | D. | 无法确定 |
分析 一定条件下,根据平衡常数的定义可知,K1=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,K2=$\frac{{c}^{\frac{3}{2}}({H}_{2})•{c}^{\frac{1}{2}}({N}_{2})}{c(N{H}_{3})}$,据此判断K1与K2的关系.
解答 解:一定条件下,根据平衡常数的定义可知,K1=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,K2=$\frac{{c}^{\frac{3}{2}}({H}_{2})•{c}^{\frac{1}{2}}({N}_{2})}{c(N{H}_{3})}$,所以$\frac{1}{{K}_{1}}$=K22,故选A.
点评 本题主要考查了平衡常数的公式,难度不大,侧重对基础知识的巩固和应用.


科目:高中化学 来源: 题型:填空题
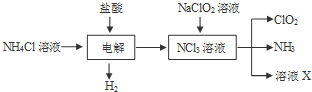
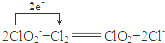 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 4:1:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol•L-1 | B. | 0.43mol•L-1 | C. | 0.8mol•L-1 | D. | 1.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)实验室可以测得下列热化学反应方程式:
(1)实验室可以测得下列热化学反应方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属氧化物、氧化铁、FeO | B. | 非金属氧化物、二氧化硫、SO2 | ||
| C. | 含氧酸、硫酸、H2SO3 | D. | 碱、纯碱、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com