
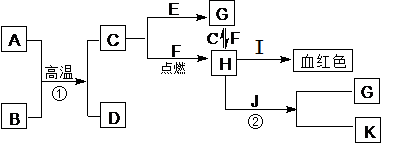
 Al2O3+2Fe 2Fe3++Cu=Cu2++2Fe2+[每空2分]
Al2O3+2Fe 2Fe3++Cu=Cu2++2Fe2+[每空2分] Al2O3+2Fe,在工业上用来焊接铁轨、冶炼金属等;C为单质,则C为Fe,H中含有铁元素且与I生成血红色物质,可知H中有Fe3+,I为KSCN或NH4SCN,紫红色金属单质J为铜;反应②在工业上可用于制作印刷电路板,则为铜与Fe3+的反应,离子方程式为2Fe3++Cu=Cu2++2Fe2+
Al2O3+2Fe,在工业上用来焊接铁轨、冶炼金属等;C为单质,则C为Fe,H中含有铁元素且与I生成血红色物质,可知H中有Fe3+,I为KSCN或NH4SCN,紫红色金属单质J为铜;反应②在工业上可用于制作印刷电路板,则为铜与Fe3+的反应,离子方程式为2Fe3++Cu=Cu2++2Fe2+

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源:不详 题型:单选题
| A.3 mol·L-1盐酸 |
| B.4 mol·L-1HNO3溶液 |
| C.5 mol·L-1NaOH溶液 |
| D.18.4 mol·L-1H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565[ |
| 沸点/℃ | 2467 | 2980 | 2750 | ┄ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe2O3 + 2Al
Fe2O3 + 2Al 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ; 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl-浓度不变 |
| B.溶液仍有浑浊 |
| C.溶液中几乎不存在Al3+ |
| D.溶液中存在最多的离子是Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2∶3 | B.1∶2 | C.1∶1 | D.3∶2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,铝能和空气里的氧气反应生成一层致密的氧化膜 |
| B.镁铝合金能完全溶于稀硝酸,同时生成无色气体,遇空气变成红棕色 |
| C.铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气 |
| D.在高温下,可以用铝制的容器装运浓硫酸或浓硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com