
【题目】下列图示与对应的叙述不相符合的是( )

A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
科目:高中化学 来源: 题型:
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
(1)![]() 泄漏会导致人体中毒,用于检测
泄漏会导致人体中毒,用于检测![]() 的传感器的工作原理如图所示:
的传感器的工作原理如图所示:

①写出电极Ⅰ上发生的反应式:__________
②工作一段时间后溶液中![]() 的浓度__________(填“变大”、“变小”或“不变”)
的浓度__________(填“变大”、“变小”或“不变”)
(2)用![]() 氧化
氧化![]() 制取
制取![]() ,可提高效益,减少污染。反应为:
,可提高效益,减少污染。反应为:![]() ,通过控制条件,分两步循环进行,可使
,通过控制条件,分两步循环进行,可使![]() 转化率接近100%,其原理如图所示:
转化率接近100%,其原理如图所示:
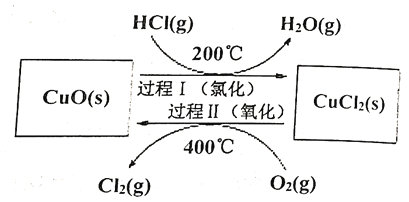
过程Ⅰ的反应为:![]()
过程Ⅱ反应的热化学方程式(![]() 用含有
用含有![]() 和
和![]() 的代数式表示)__________。
的代数式表示)__________。
(3)在温度![]() ,容积为
,容积为![]() 的绝热容器中,充入
的绝热容器中,充入![]() ,发生反应:
,发生反应:![]() ,容器中
,容器中![]() 的相关量随时间变化如图所示。
的相关量随时间变化如图所示。

①反应到![]() 时,
时,![]() 的转化率是__________。
的转化率是__________。
②根据图示,以下各点表示反应达到平衡状态的是________。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
③![]() 内容器中
内容器中![]() 的反应速率增大,而
的反应速率增大,而![]() 后容器中
后容器中![]() 的反应速率减小了,原因是_______。
的反应速率减小了,原因是_______。
④此容器中反应达平衡时,温度若为![]() ,此温度下的平衡常数
,此温度下的平衡常数![]() =__________。
=__________。
(4)工业上可用![]() 溶液吸收法处理
溶液吸收法处理![]() ,25℃时用
,25℃时用![]() 的
的![]() 溶液吸收
溶液吸收![]() ,当溶液
,当溶液![]() 时,溶液中各离子浓度的大小关系为:
时,溶液中各离子浓度的大小关系为:![]() 。(已知25℃时:
。(已知25℃时:![]() 的电离常数
的电离常数![]() ,
,![]() )请结合所学理论通过计算说明
)请结合所学理论通过计算说明![]() 的原因__________。
的原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组的同学根据理论分析后认为,NO2可能会氧化单质铜,他们设想利用下图所示装置验证NO2的氧化性(夹持装置已省略)。
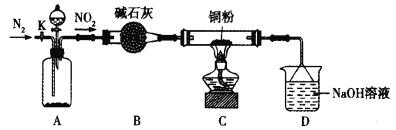
(1)装置A~C中有一处错误,改正的方法是________,A中发生反应的两种试剂通常是_____。
(2)点燃C处酒精灯比较合适的时机是_________。若C中固体全部变成黑色,同时生成对环境无污染的气体,写出C中反应的化学方程式:_____。装置D的用途是__________。
(3)开关K的设计是以实现绿色化学实验为目的,请说明K的使用方法:_______(包括使用时段与内容)。
(4)实验结束后发现C中的固体混有少量的红色粉末,经过分析,甲同学认为该红色粉末是Cu2O,乙同学认为该红色粉末是Cu,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
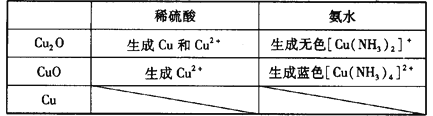
请设计一个简单的实验证明甲同学的看法是否正确:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶态分散系是一种粒子直径介于1~100nm的一种分散系,如图是Fe(OH)3胶体的结构示意图,下列说法不正确的是( )
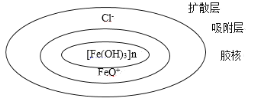
A.据图可以判断,发生了Fe(OH)3(胶体)+HCl![]() FeOCl+2H2O的反应
FeOCl+2H2O的反应
B.当用其做电泳实验时,阴极管的液面低于阳极管
C.电泳实验出现的现象的原因是:扩散层与吸附层分离,带正电的胶核向阴极移动
D.若对其加热一段时间,会发生胶体的聚沉作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,用化学方程式表示该反应的原理.___________________________________________
(2)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式
___________________________________
(3)取少量Fe2O3粉末(红棕色)加入适量盐酸,该反应的离子方程式为______________________;用此溶液进行以下反应,取少量溶液于一支试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】转鼓指数是反映烧结矿的机械强度的物理性能指标,其值越大,机械强度越好。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如下:
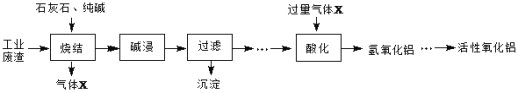
(1)烧结产物主要有NaAlO2、CaSiO3、NaFeO2及气体X。气体X是_________。
(2)烧结产物NaAlO2也可以通过所学知识由Al2O3转化得到,写出反应的离子方程式____
(3)写出由氢氧化铝制备氧化铝的化学方程式:____________________。
(4)碱浸前需将烧结产物进行粉碎,其目的是_________。碱浸过程中,NaFeO2可与水应生成NaOH和一种含铁的化合物,写出该反应的化学方程式_________________。
(5)某同学设计了由废渣(Al2O3、Fe2O3)制备纯净的Al2(SO4)3·18H2O晶体的实验步骤。请利用所学和流程中的信息补充完整:向一定量滤渣中加入足量的稀硫酸,充分反应,无不溶物后,滴加NaOH溶液至生成的沉淀不再减少,过滤,__________,将所得溶液蒸发浓缩,冷却结晶,过滤,抽干,装瓶。(实验中必须使用的试剂:CO2气体、稀硫酸、蒸馏水)
(6)已知试剂EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应。现测定硫酸铝晶体样品中Al2(SO4)3·18H2O(摩尔质量为666g/mol)质量分数的实验步骤如下:(杂质不与EDTA反应)
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却。
步骤3:再向上述溶液中加入c2 mol·L- 1Pb(NO3)2 溶液V2mL 恰好与过量的EDTA溶液完全反应。
请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。__________(写出具体计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A.在500 ℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN的大
C.25 ℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D.2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g。下列说法正确的是( )
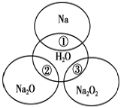
A.反应③最多能产生0.05molO2
B.反应①的离子方程式为Na+2H2O=Na++2OH-+H2↑
C.①、②、③都属于氧化还原反应
D.①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应xH2S(g)![]() xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )
xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )
A.若恒容充入H2,则新平衡后H2S分解率下降
B.若增大压强,气体颜色变深,则Sx为有色气体
C.若恒容升温后,气体密度不变,说明达到了新平衡
D.若改变某一条件后,压强不能作为判断新平衡的标志,则Sx状态发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com