
【题目】下表是氧化镁和氯化镁的熔、沸点数据:请参考以上数据分析,从海水中提取镁,正确的方法是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2852 | 714 |
沸点/℃ | 3600 | 1410 |
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2晶体
MgCl2晶体![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融) ![]() Mg
Mg
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,下列说法正确的是
A. 等体积CH4和HF所含的电子数相同
B. pH=12的Na2CO3溶液中c(OH-)=1×10-2 mol/L
C. 2.4 g Mg与足量的盐酸反应,放出的气体体积为2.24 L
D. 由H2O2制2.24 L O2转移的电子数目为0.4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 0.175 mol·L-1醋酸钠溶液500 mL,(已知室温下,醋酸的电离平衡常数Ka=1.75×10-5)。
⑴ 写出醋酸钠水解反应的化学方程式______________________________;
⑵ (双选)下列图象能说明醋酸钠的水解反应达到平衡的是____________;
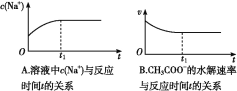
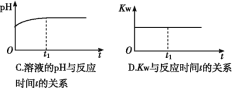
⑶ (双选)向醋酸钠溶液中加入少量下列物质,水解平衡向正向移动的有______;
A.冰醋酸 B.纯碱固体 C.醋酸钠固体 D.氯化铵固体
⑷ (双选)在醋酸钠溶液中加入冰醋酸,溶液中微粒浓度的关系式能成立的有__________;
A.c(CH3COO-) + c(CH3COOH) > c(Na+)
B.c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
C.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.c(CH3COO-) > c(H+) > c(OH-) > c(Na+)
⑸ 欲配制0.175 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案:
方案一:用托盘天平称取___________g无水醋酸钠,溶于适量水中,配成500 mL溶液。[已知:M(CH3COONa) = 82g/mol ]
方案二:用体积均为250 mL且浓度均为___________mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
⑹ 在室温下,0.175 mol·L-1醋酸钠(CH3COONa)溶液的pH约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状态( )
A.CuSO4B.CuOC.Cu(OH)2D.CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。下列说法不正确的是
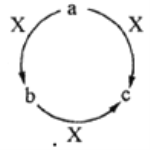
A. 若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
B. 若a为一种气态氢化物,X为O2,则a分子中可能含有10个或者18个电子
C. 若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
D. 若a为固态非金属单质,X为O2,则O元素与a元素的原子序数之差可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨肥样品可能含有NH4HCO3、NH4Cl、.NH4NO3中的一种或几种。称取该样品1.000克,溶于水配成100mL溶液,将溶液分成两等份依次完成如下实验:
①向一份溶液中加入10mL0.2 mol·L-1的盐酸与之充分反应,可收集到标准状况下的CO2气体44.8mL(设产生的CO2全部逸出)。
②向另一份溶液中加入足量的6mol·L-1氢氧化钠溶液,加热,产生的气体(设产生的NH3全部逸出)至少需要25mlL0.15 mol·L-1的硫酸才能被完全反应。下列说法正确的是
A. 1.000g样品中一定含有NH4HCO30.316克
B. 向①反应所得的溶液中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,说明原样品中一定含有NH4Cl
C. 原样品的含氨量为21%
D. 无需另外再设计实验验证,就能确定原样品中是否含有NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
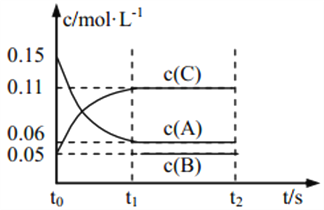
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同。下列说法正确的是
A. X的氢化物中仅含有极性键
B. X与Y形成的三原子分子的电子式是![]()
C. 原子半径Z>Y,离子半径Z2+< Y2-
D. X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com