


 ;
;分析 (1)选取含有碳碳双键的碳原子最多的链为主链,选取离碳碳双键最近的碳原子为1号碳原子给A命名;
(2)结合题给信息知,该反应发生题给信息的反应,A的结构简式为CH2=C(CH3)-CH=CH2,则B结构简式为CH2=CHCOOCH2CH3,根据结构简式确定分子式;
(3)反应②为加成反应,根据反应物和生成物写方程式;
(4)根据反应特点知,①和②的反应类型都是加成反应.
解答 解:(1)选取含有碳碳双键的碳原子最多的链为主链,选取离碳碳双键最近的碳原子为1号碳原子给A命名,则A的名称是2-甲基-1,3-丁二烯,故答案为:2-甲基-1,3-丁二烯;
(2)结合题给信息知,该反应发生题给信息的反应,A的结构简式为CH2=C(CH3)-CH=CH2,则B结构简式为
CH2=CHCOOCH2CH3,根据结构简式确定分子式为C5H8O2,故答案为:C5H8O2;
(3)反应②为加成反应,根据反应物和生成物写方程式为 ,故答案为:
,故答案为: ;
;
(4)根据反应特点知,①和②的反应类型都是加成反应,故答案为:加成反应;加成反应.
点评 本题考查有机物结构和性质,为高频考点,根据反应前后某些物质分子式及结构简式变化结合题给信息确定反应类型,侧重考查学生分析判断及知识迁移能力,题目难度不大.


科目:高中化学 来源: 题型:解答题
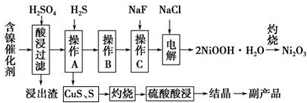 为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的最高价氧化物对应水化物是强碱 | |
| B. | 原子半径:Y<Z<W | |
| C. | X、Y可以形成既有极性键也有非极性键的化合物 | |
| D. | 原子最外层电子数:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
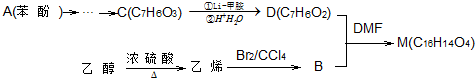
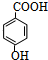

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | Al3++H2O?Al(OH)3+H+ | ||
| C. | CH3COOH+NaOH?CH3COONa+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①和②都是离子反应 | B. | 反应①和②都吸收热量 | ||
| C. | 反应①和②都放出热量 | D. | 反应③既不吸收热量也不放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
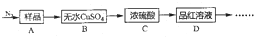
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g CH4所含共价键数目为2NA | |
| B. | 0.5NA 个氯气分子与水反应转移电子数为0.5NA | |
| C. | 50mL12mol/L盐酸与足量的MnO2共热,转移的电子数为0.3NA | |
| D. | 1 L0.2mol/L的Na2S溶液中离子数为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com