
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | | ② | ③ | |
| 3 | ⑧ | | ⑨ | ④ | | ⑤ | ⑥ | ⑦ |
| 4 | | | | | | | ⑩ | |
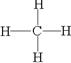 SP3 正四面体
SP3 正四面体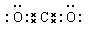 共价 原子 二氧化硅 形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量。
共价 原子 二氧化硅 形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量。 。
。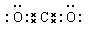 。C和Si通过极性键形成共价化合物SiC,是原子晶体,熔点高。这是由于形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量,所以熔点很高。
。C和Si通过极性键形成共价化合物SiC,是原子晶体,熔点高。这是由于形成的SiC的共价键的键能很大,破坏共价键需要消耗大量的能量,所以熔点很高。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源:不详 题型:单选题
| A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强 |
| B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
| C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D.第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BF3、NF3分子的价层电子对互斥模型均为平面正三角形 |
| B.H—Cl的键能为431.8 kJ·mol—1,H—I的键能为298.7 kJ·mol—1,这可以说明HCl分子比HI分子稳定 |
| C.可燃冰是甲烷的结晶水合物,甲烷可与水形成氢键 |
| D.因为N—H键能比P—H大,所以NH3沸点比PH3高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com