
(15分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
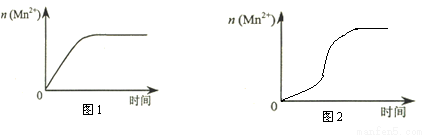
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 |
| t |
③若该小组同学提出的假设成立,应观察到的现象是 。
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为 ;总方程式为 。
(1)其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大(3分,每点1分)
(2)1.0×10-2 mol / (L·min) (2分)
(3) ①生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用)[2分,不指出MnSO4(或Mn2+)扣1分] ② MnSO4 (2分)
③ 与实验1比较,溶液褪色所需时间短(2分,不写“与实验1比较”扣1分) 或:所用时间(t)小于1.5min(或其他合理答案)
(4)2MnO42--2e-=2MnO4-(或 MnO42--e-=MnO4- ) (2分);
2K2MnO4+2H2O电解2KMnO4+2KOH+H2↑(2分)
【解析】
试题分析:(1)根据表中数据可知,其他条件相同时,增大H2C2O4浓度(反应物浓度),反应速率增大。
(2)反应中消耗高锰酸钾的浓度是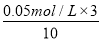 =0.015mol/L,所以υ(KMnO4)=0.015mol/L÷1.5min=1.0×10-2 mol / (L·min)。
=0.015mol/L,所以υ(KMnO4)=0.015mol/L÷1.5min=1.0×10-2 mol / (L·min)。
(3)①由图2可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂.
②要验证假设作对比实验与与实验1比较,其它条件相同时加入MnSO4即可。
③如果假设成立,则加入硫酸锰以后若反应加快,溶液褪色的时间小于1.5min,说明Mn2+是催化剂.
(4)K2MnO4制取KMnO4,反应过程中Mn元素的化合价从+6价升高到+7价,因此锰酸钾在阳极放电,电极反应式为MnO42--e-=MnO4-,阴极是溶液中的氢离子放电产生氢气,所以总反应式为2K2MnO4+2H2O电解2KMnO4+2KOH+H2↑。
考点:考查反应速率计算、外界条件对反应速率的影响以及电解原理的应用


科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷乙(解析版) 题型:选择题
a升CO和O2的混和气体,点燃后得到b升气体(前后条件相同),则混和气体中CO的体积可能是下列组合中的 ( )
①b ②2a/3 ③a-b ④a+b ⑤2(a-b)
A.①②③ B.②④⑤ C.①②④ D.①②⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省江门市高二调研测试理综化学试卷(解析版) 题型:填空题
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。
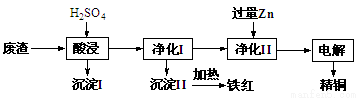
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省梅州市高一下学期期中化学试卷(解析版) 题型:选择题
下列事实一般不能用于判断金属性强弱的是( )
A.金属的颜色和熔沸点
B.金属元素的最高价氧化物对应的水化物的碱性强弱
C.1mo金属单质在反应中失去电子的多少
D.金属元素的单质和水或酸置换出氢的难易
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省梅州市高一下学期期中化学试卷(解析版) 题型:选择题
下列各组比较不正确的是 ( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故
C.容沸点:Li>Na>K
D.原子半径:Li<Na<K
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省揭阳市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
下列实验操作正确且能达到预期目的的是
| 实验目的 | 操作 |
A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液,看紫红色是否褪去 |
C | 确定碳、氯两元素非金属性的强弱 | 测定同温同浓度的Na2CO3和NaClO水溶液的pH |
D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:计算题
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴ 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
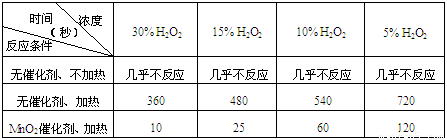
① 该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
② 从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:
。
⑵ 将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
① 写出H2O2发生的化学反应方程式 _______________ ______。
② 实验结果说明催化剂作用的大小与________ _________ 有关。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
已知反应A2(g)+2B2(g) 2AB2(g)△H <0,下列说法正确的
2AB2(g)△H <0,下列说法正确的
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
下列物质能用铁制器皿盛放的是
A.浓硫酸 B.稀硫酸 C. 氯化铜溶液 D.氯化铁溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com