
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:不详 题型:单选题
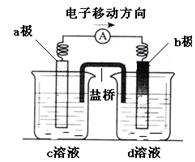
| A.d溶液是稀硫酸 |
| B.c溶液颜色变蓝 |
| C.b极发生氧化反应 |
| D.a极是铜棒 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锌片是正极 | B.电流方向从锌片流向铜片 |
| C.氢气在锌片上产生 | D.若锌片、铜片同时有气泡冒出,则说明锌片不纯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加6.5g | B.减少5.6g | C.增加11.2g | D.减少13g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe、Cu、浓硝酸溶液,负极反应式为:Fe-2e-==Fe2+ |
| B.Al、Cu、稀硫酸,负极反应式为:Cu-2e-==Cu2+ |
| C.Al、Mg、NaOH溶液,负极反应式为:Al+4OH--3e-==AlO2-+2H2O |
| D.Zn、Cu、乙醇,负极反应式为:Zn-2e-==Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(s)+H2O(g)= CO(g)+H2(g) |
| B.HCl + NaOH = NaCl + H2O |
C.Ca(OH)2+2NH4Cl 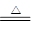 CaCl2 + 2NH3↑ + 2H2O CaCl2 + 2NH3↑ + 2H2O |
| D.CH4(g)+2O2(g)= CO2(g)+2H2O(l) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
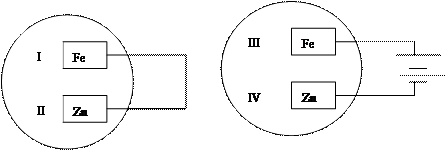
| A.I和III | B.I和IV | C.II和III | D.II和IV |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锌为负极,锌发生氧化反应 |
| B.铜为正极,但铜不发生反应 |
| C.负极发生还原反应,正极发生氧化反应 |
| D.外电路电子流入的一极为正极,电子流出的一极为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com