
”¾ĢāÄæ”æ£Ø1£©ŅŃÖŖ20”ꏱµÄČܽā¶Č£ŗNa2CO3£ŗS£½21.2g£» NaHCO3£ŗS£½9.6g”£Ōņ20oCŗćĪĀĢõ¼žĻĀĻņ121.2g±„ŗĶĢ¼ĖįÄĘČÜŅŗÖŠĶØČė×ćĮæµÄCO2ĘųĢ壬ĄķĀŪÉĻæÉŅŌĪö³öNaHCO3__________g(Š”Źżµćŗó±£Įō1Ī»)
£Ø2£©Ļņ500mL KOHČÜŅŗÖŠ»ŗĀżĶØČėŅ»¶ØĮæµÄ![]() ĘųĢ壬³ä·Ö·“Ó¦ŗó£¬ŌŚ¼õŃ¹µĶĪĀĻĀÕō·¢ČÜŅŗ£¬µĆµ½°×É«¹ĢĢ唣ČōĶØČė
ĘųĢ壬³ä·Ö·“Ó¦ŗó£¬ŌŚ¼õŃ¹µĶĪĀĻĀÕō·¢ČÜŅŗ£¬µĆµ½°×É«¹ĢĢ唣ČōĶØČė![]() ĘųĢåĪŖ2£®24L(±ź×¼×“æöĻĀ)£¬µĆµ½11£®9gµÄ°×É«¹ĢĢ唣ŌņĖłÓƵÄKOHČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ______mol/L”£
ĘųĢåĪŖ2£®24L(±ź×¼×“æöĻĀ)£¬µĆµ½11£®9gµÄ°×É«¹ĢĢ唣ŌņĖłÓƵÄKOHČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ______mol/L”£
£Ø3£©½«Ņ»¶ØÖŹĮæµÄÄĘ¼ÓČėµ½89gĖ®ÖŠ£¬ĶźČ«·“Ó¦ŗóµÄČÜŅŗĪŖ100g£¬ŌņøĆČÜŅŗµÄÖŹĮæ·ÖŹżĪŖ________
£Ø4£©ĻÖÓŠ¼×”¢ŅŅĮ½ĘæĪŽÉ«ČÜŅŗ£¬ŅŃÖŖĖüĆĒæÉÄÜŹĒAlCl3ČÜŅŗŗĶNaOHČÜŅŗ.ĻÖ×öČēĻĀŹµŃé£ŗ
¢Ł Č”440mL¼×Óė120mLŅŅ·“Ó¦£¬²śÉś1.56g³Įµķ£»
¢Ś Č”440mLŅŅÓė120mL¼×·“Ó¦£¬Ņ²²śÉś1.56g³Įµķ£»
¢Ū Č”120mL¼×ČÜŅŗÓė400mLŅŅČÜŅŗ·“Ó¦£¬Ōņ²śÉś3.12g³Įµķ£»
Ķعż±ŲŅŖµÄ¼ĘĖćŗĶĶĘĄķÅŠ¶Ø£ŗ
¼×ČÜŅŗĪŖ ČÜŅŗ£¬ĘäĪļÖŹµÄĮæÅضČĪŖ mol”¤L-1£»
ŅŅČÜŅŗĪŖ ČÜŅŗ£¬ĘäĪļÖŹµÄĮæÅØ¶ČŹĒ mol”¤L-1
”¾“š°ø”æ£Ø1£©24.3£»£Ø2£©0.3 £»£Ø3£©20%£»£Ø4£©AlCl3 0.5mol/L£»NaOH 0.5mol/L
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©20”ꏱ£¬øł¾ŻĢ¼ĖįÄʵÄČܽā¶ČÖŖ£¬121.2g±„ŗĶĢ¼ĖįÄĘČÜŅŗÖŠĢ¼ĖįÄʵÄÖŹĮæĪŖ21.2g£¬ČܼĮµÄÖŹĮæŹĒ100g£¬100gĖ®ÖŠČܽāĢ¼ĖįĒāÄʵÄÖŹĮæĪŖ9.6g£¬øł¾ŻÄĘŌ×ÓŹŲŗćÖŖ£¬Éś³ÉĢ¼ĖįĒāÄʵÄÖŹĮæ=![]() ”Į2”Į84g/molØT33.6g£¬øł¾ŻNa2CO3+H2O+CO2=2NaHCO3ÖŖ£¬21.2gĢ¼ĖįÄĘ²Ī¼Ó·“Ó¦ŠčŅŖĖ®µÄÖŹĮæ=
”Į2”Į84g/molØT33.6g£¬øł¾ŻNa2CO3+H2O+CO2=2NaHCO3ÖŖ£¬21.2gĢ¼ĖįÄĘ²Ī¼Ó·“Ó¦ŠčŅŖĖ®µÄÖŹĮæ=![]() ”Į18g/mol=3.6g£¬ĖłŅŌČܼĮµÄÖŹĮæĪŖ100g-3.6g=96.4g£¬ČܽāĢ¼ĖįĒāÄʵÄÖŹĮæ=
”Į18g/mol=3.6g£¬ĖłŅŌČܼĮµÄÖŹĮæĪŖ100g-3.6g=96.4g£¬ČܽāĢ¼ĖįĒāÄʵÄÖŹĮæ=![]() ”Į96.4g=9.3g£¬ĖłŅŌĪö³öĢ¼ĖįĒāÄʵÄÖŹĮæ=33.6g-9.3g=24.3g£¬¹Ź“š°øĪŖ£ŗ24.3£»
”Į96.4g=9.3g£¬ĖłŅŌĪö³öĢ¼ĖįĒāÄʵÄÖŹĮæ=33.6g-9.3g=24.3g£¬¹Ź“š°øĪŖ£ŗ24.3£»
£Ø2£©±ź×¼×“æöĻĀ£¬2.24LCO2µÄĪļÖŹµÄĮæĪŖ0.1mol£¬µ±²śĪļČ«²æĪŖK2CO3Ź±£ŗm(K2CO3) = 0.1 mol ”Į 138 gmol-1 = 13.8g£¬µ±²śĪļČ«²æĪŖKHCO3Ź±£ŗm(KHCO3)=0.1mol”Į100gmol-1=10g£¬10g£¼11.9g£¼13.8g£¬¹Ź°×É«¹ĢĢå³É·ÖĪŖK2CO3ŗĶKHCO3µÄ»ģŗĻĪļ£¬ÉčK2CO3”¢KHCO3µÄĪļÖŹµÄĮæ·Ö±šĪŖx”¢y”£x+y=0.1mol£¬138gmol-1x + 100 gmol-1y = 11.9g£¬½āµĆ£ŗx=0.05mol£¬y=0.05mol£¬ÓÉKŌŖĖŲŹŲŗćæÉµĆ£ŗc(KOH) = ![]() = 0.3 molL-1£»¹Ź“š°øĪŖ£ŗ0.3molL-1£»
= 0.3 molL-1£»¹Ź“š°øĪŖ£ŗ0.3molL-1£»
£Ø3£©ÉčÄʵÄÖŹĮæĪŖx
2Na + 2H2O ØT 2NaOH + H2”ü
46 36 80
x m(H2O) m(NaOH)
Ōņm(H2O)= ![]() x£¬m(NaOH)=
x£¬m(NaOH)= ![]() x£¬(89g-
x£¬(89g-![]() x)+
x)+ ![]() x=100g£¬
x=100g£¬
½āµĆx=![]() g£¬ĒāŃõ»ÆÄĘČÜŅŗµÄÖŹĮæ·ÖŹż=
g£¬ĒāŃõ»ÆÄĘČÜŅŗµÄÖŹĮæ·ÖŹż=![]() g”Į
g”Į![]() ”Ā100g=0.2£¬¹Ź“š°øĪŖ£ŗ0.2
”Ā100g=0.2£¬¹Ź“š°øĪŖ£ŗ0.2
£Ø4£©ÓÉ¢ŚŗĶ¢ŪæÉÖŖ£¬Ņ»¶ØĮæµÄ¼×ÓėŅŅ·“Ó¦Ź±£¬ŅŅµÄĮæŌ½¶ą£¬Éś³ÉµÄ³ĮµķŌ½ÉŁ£¬ŌņŅŅĪŖNaOHČÜŅŗ£¬¼“¼×ĪŖAlCl3ČÜŅŗ£¬ŌŚ¢ŁÖŠ·¢ÉśAlCl3+3NaOHØTAl(OH)3”ż+3NaCl£¬1.56g³ĮµķµÄĪļÖŹµÄĮæĪŖ![]() =0.02mol
=0.02mol![]() =0.5mol/L£¬ŌŚ¢ŚÖŠ·¢ÉśAlCl3+3NaOHØTAl(OH)3”ż+3NaCl”¢Al(OH)3+NaOHØTNaAlO2+2H2O£¬¼ŁÉč³ö³Įµķ×ī“óĮæxmol£¬æŖŹ¼³Įµķ¹ż³ĢĻūŗÄĒāŃõøłĄė×Ó3xmol£¬³ĮµķČܽā¹ż³ĢĒāŃõ»ÆĀĮÓėĒāŃõ»ÆÄĘ1£ŗ1·“Ó¦£¬×īŗóÉś³É0.02molĒāŃõ»ÆĀĮ£¬ĖłŅŌĻūŗÄĒāŃõ»ÆÄĘ(x-0.02)mol£¬ŌņŅ»¹²ĻūŗÄĒāŃõ»ÆÄĘĪŖ3x + (x - 0.02) = 0.44L ”Į 0.5 mol/L = 0.22 mol£¬½āµĆx=0.06mol£¬¼“×ī¶ąÓŠĒāŃõ»ÆĀĮ0.06mol£¬ĖłŅŌŌČÜŅŗŗ¬ĀĮĄė×Ó0.06mol£¬ĀČ»ÆĀĮÅضČĪŖ
=0.5mol/L£¬ŌŚ¢ŚÖŠ·¢ÉśAlCl3+3NaOHØTAl(OH)3”ż+3NaCl”¢Al(OH)3+NaOHØTNaAlO2+2H2O£¬¼ŁÉč³ö³Įµķ×ī“óĮæxmol£¬æŖŹ¼³Įµķ¹ż³ĢĻūŗÄĒāŃõøłĄė×Ó3xmol£¬³ĮµķČܽā¹ż³ĢĒāŃõ»ÆĀĮÓėĒāŃõ»ÆÄĘ1£ŗ1·“Ó¦£¬×īŗóÉś³É0.02molĒāŃõ»ÆĀĮ£¬ĖłŅŌĻūŗÄĒāŃõ»ÆÄĘ(x-0.02)mol£¬ŌņŅ»¹²ĻūŗÄĒāŃõ»ÆÄĘĪŖ3x + (x - 0.02) = 0.44L ”Į 0.5 mol/L = 0.22 mol£¬½āµĆx=0.06mol£¬¼“×ī¶ąÓŠĒāŃõ»ÆĀĮ0.06mol£¬ĖłŅŌŌČÜŅŗŗ¬ĀĮĄė×Ó0.06mol£¬ĀČ»ÆĀĮÅضČĪŖ![]() =0.5mol/L£¬¹Ź“š°øĪŖ£ŗAlCl3 0.5£»NaOH 0.5
=0.5mol/L£¬¹Ź“š°øĪŖ£ŗAlCl3 0.5£»NaOH 0.5



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹµÄŹ¹ÓĆ²»Éę¼°»Æѧ±ä»ÆµÄŹĒ
A£®Ć÷·ÆÓĆ×ö¾»Ė® B£®Ņŗ°±ÓĆ×÷ÖĘĄä¼Į C£®Ēā·śĖįæĢŹ“²£Į§ D£®ÉśŹÆ»Ņ×÷øÉŌļ¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆŗĻĪļAµÄ½į¹¹¼ņŹ½ĪŖ![]() £¬ĪŖĮĖŃŠ¾æXµÄ½į¹¹£¬½«»ÆŗĻĪļAŌŚŅ»¶ØĢõ¼žĻĀĖ®½āÖ»µĆµ½B(·Ö×ÓŹ½ĪŖC8H8O3)ŗĶC(·Ö×ÓŹ½ĪŖC7H6O3)”£CÓöFeCl3Ė®ČÜŅŗĻŌ×ĻÉ«£¬ÓėNaHCO3ČÜŅŗ·“Ó¦ÓŠCO2²śÉś”£
£¬ĪŖĮĖŃŠ¾æXµÄ½į¹¹£¬½«»ÆŗĻĪļAŌŚŅ»¶ØĢõ¼žĻĀĖ®½āÖ»µĆµ½B(·Ö×ÓŹ½ĪŖC8H8O3)ŗĶC(·Ö×ÓŹ½ĪŖC7H6O3)”£CÓöFeCl3Ė®ČÜŅŗĻŌ×ĻÉ«£¬ÓėNaHCO3ČÜŅŗ·“Ó¦ÓŠCO2²śÉś”£
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©»ÆŗĻĪļAµÄ·Ö×ÓŹ½ ”£
£Ø2£©»ÆŗĻĪļBÄÜ·¢ÉśĻĀĮŠ·“Ó¦ĄąŠĶµÄÓŠ________”£
a£®Č”“ś·“Ó¦ b£®¼Ó³É·“Ó¦ c£®Ėõ¾Ū·“Ó¦ d£®ĻūČ„·“Ó¦
£Ø3£©»ÆŗĻĪļCÄܾĻĀĮŠ·“Ó¦µĆµ½G(·Ö×ÓŹ½ĪŖC8H6O2£¬·Ö×ÓÄŚŗ¬ÓŠĪåŌŖ»·)£»

ŅŃÖŖ£ŗ£Ø¢ń£©RCOOH![]() RCH2OH£»
RCH2OH£»
£Ø¢ņ£©¾ŹµŃé²ā¶ØÖŠ¼äÉś³ÉĪļEÓöFeCl3ĻŌ×ĻÉ«£»
£Ø¢ó£©R”ŖBr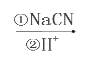 R”ŖCOOH”£
R”ŖCOOH”£
¢ŁČ·ČĻ»ÆŗĻĪļCµÄ½į¹¹¼ņŹ½ĪŖ__________________________”£
¢Ś»ÆŗĻĪļEÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬Ęä֊ijŠ©Ķ¬·ÖŅģ¹¹Ģåŗ¬ÓŠ±½»·£¬ĒŅ±½»·ÉĻÓŠĮ½ÖÖ²»Ķ¬»Æѧ»·¾³µÄĒā£¬Š“³öÕāŠ©Ķ¬·ÖŅģ¹¹ĢåÖŠČĪŅāĮ½ÖֵĽį¹¹¼ņŹ½£ŗ______________________________”£
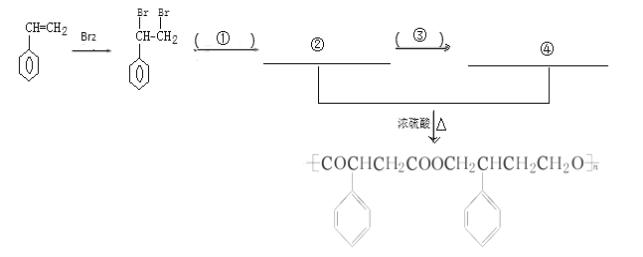
£Ø4£©Ķź³ÉĻĀĮŠŅŌ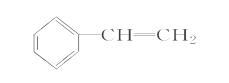 ĪŖÖ÷ŅŖŌĮĻÖʱø
ĪŖÖ÷ŅŖŌĮĻÖʱø
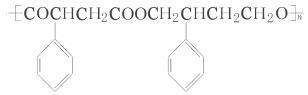 µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼(ĪŽ»śŹŌ¼ĮČĪŃ”)”£
µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼(ĪŽ»śŹŌ¼ĮČĪŃ”)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧŹ½ĪŖC2H6OµÄ»ÆŗĻĪļA¾ßÓŠČēĻĀŠŌÖŹ£ŗA£«NaØD”śĀżĀż²śÉśĘųÅŻ
A£«CH3COOH![]() ÓŠĻćĪ¶µÄ²śĪļ
ÓŠĻćĪ¶µÄ²śĪļ
£Ø1£©øł¾ŻÉĻŹöŠÅĻ¢£¬¶ŌøĆ»ÆŗĻĪļæÉ×÷³öµÄÅŠ¶ĻŹĒ( )”£
A£®Ņ»¶Øŗ¬ÓŠ”ŖOH B£®Ņ»¶Øŗ¬ÓŠ”ŖCOOH C£®AĪŖŅŅ“¼ D£®AĪŖŅŅČ©
£Ø2£©ŗ¬AµÄĢå»ż·ÖŹżĪŖ75%µÄĖ®ČÜŅŗæÉŅŌÓĆ×÷_______________________”£
£Ø3£©AÓėÄĘ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ______________________________________________”£
£Ø4£©»ÆŗĻĪļAÓėCH3COOH·“Ӧɜ³ÉµÄÓŠĻćĪ¶µÄ²śĪļµÄ½į¹¹¼ņŹ½ĪŖ£ŗ________”£
£Ø5£©Š“³öA·Ö×ÓŌŚ“߻ƼĮ“ęŌŚĢõ¼žĻĀ¼ÓČČŗĶŃõĘų·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ___________________”£
£Ø6£©ČēĶ¼ŹĒB·Ö×ÓµÄĒņ¹÷Ä£ŠĶŗĶA·Ö×ӵıȥżÄ£ŠĶ£¬ČōAŗĶBµÄ¹ŲĻµŹĒĶ¬ĻµĪļ£¬ŌņBµÄ½į¹¹¼ņŹ½_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒė׊Ļø¹Ū²ģĻĀĮŠĪåÖÖ×°ÖĆµÄ¹¹ŌģŹ¾ŅāĶ¼£¬Ķź³ÉĻĀĮŠĪŹĢā”£
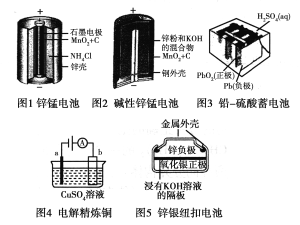
(1)ŠæĆĢµē³Ų“ęŌŚ×Ō·ÅµēĻÖĻó£¬Ö÷ŅŖŌŅņŹĒŠæÓėNH4Cl·“Ó¦£¬Ēė½įŗĻĄė×Ó·½³ĢŹ½ÓėĪÄ×ÖĖµĆ÷ŌŅņ£ŗ
ӣ
£Ø2£©¼īŠŌŠæĆĢµē³ŲµÄ×Ü·“Ó¦Ź½£ŗZn£«2MnO2£«2H2O===2MnOOH£«Zn(OH)2£¬Ōņøŗ¼«µÄµē¼«·“Ó¦Ź½£ŗ________________”£
£Ø3£©Ē¦£ĮņĖįŠīµē³Ų·ÅµēµÄ×Ü·“Ó¦Ź½£ŗPb+PbO2+2H2SO4=2PbSO4+2H2O,³äµē¹ż³ĢÖŠ£¬Ńō¼«ø½½üc(SO42-)ÅØ¶Č½«________(Ģī”°±ä“ó”±”¢”°±äŠ””±»ņ”°²»±ä”±)£¬³äµēŹ±Ņõ¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ________________”£
£Ø4£©µē½ā¾«Į¶ĶŹ±£¬a¼«ŹĒ________(Ģī”°“æĶ”±»ņ”°“ÖĶ”±)”£ŠæŅųŦæŪµē³ŲŌŚ¹¤×÷¹ż³ĢÖŠ________(ĢīĪļÖŹĆū³Ę)±»»¹Ō”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĻĀĮŠŌŖĖŲÖŠ£¬²»ŹōÓŚÖ÷×åŌŖĖŲµÄŹĒ£Ø £©
A. p B. Fe C. Ca D. I
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĘĻĢŃæÉÓĆÓŚÄš¾Ę”£
£Ø1£©¼ģŃéĘĻĢŃÖŗ¬ĘĻĢŃĢĒµÄ·½·ØŹĒ£ŗĻņĘäÖŠ¼Ó¼īµ÷ÖĮ¼īŠŌ£¬ŌŁ¼ÓČėŠĀÖʱøµÄCu£ØOH£©2£¬¼ÓČČ£¬ĘäĻÖĻóŹĒ ”£
£Ø2£©ÓŠ»śĪļEÓÉĢ¼”¢Ēā”¢ŃõČżÖÖŌŖĖŲ×é³É£¬æÉÓÉĘĻĢŃĢĒ·¢½ĶµĆµ½£¬Ņ²æÉ“ÓĖįÅ£ÄĢÖŠĢįČ”£¬“æ¾»µÄEĪŖĪŽÉ«Õ³³ķŅŗĢ壬Ņ×ČÜÓŚĖ®”£ĪŖŃŠ¾æEµÄ×é³ÉÓė½į¹¹£¬ĶعżŹµŃéµĆµ½ČēĻĀŠÅĻ¢£ŗ
¢ŁÓŠ»śĪļEµÄĻą¶Ō·Ö×ÓĮæĪŖ90”£9.0g EĶźČ«Č¼ÉÕŹ±£¬Éś³ÉCO2 0.3mol£¬ H2O5.4g”£ŌņÓŠ»śĪļEµÄ·Ö×ÓŹ½ĪŖ ”£
¢ŚŹµŃéÖ¤ŹµĘäÖŠŗ¬ÓŠōĒ»ł£¬ōČ»ł£¬¼×»ł£¬ŌņEµÄ½į¹¹¼ņŹ½ĪŖ ”£
¢ŪŠ“³öEÓė×ćĮæNaµÄ»Æѧ·½³ĢŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”«GŹĒ¼øÖÖĢžµÄ·Ö×ÓĒņ¹÷Ä£ŠĶ(ČēĶ¼)£¬¾Ż“Ė»Ų“šĻĀĮŠĪŹĢā£ŗ


£Ø1£©³£ĪĀĻĀŗ¬Ģ¼Įæ×īøßµÄĘųĢ¬ĢžŹĒ________(Ģī×ÖÄø)”£
£Ø2£©Äܹ»·¢Éś¼Ó³É·“Ó¦µÄĢžÓŠ________ÖÖ”£
£Ø3£©Ņ»Ā±“śĪļÖÖĄą×ī¶ąµÄŹĒ________(ĢīŠ“×ÖÄø)”£
£Ø4£©Š“³öŹµŃéŹŅÖĘDµÄ»Æѧ·½³ĢŹ½£ŗ
_____________________________________________________________
£Ø5£©Š“³öF·¢ÉśĻõ»Æ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ
_____________________________________________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆĮāĆĢæó£ØÖ÷ŅŖŗ¬MnCO3”¢FeCO3”¢Al2O3”¢SiO2£©ÖʱøMnSO4”¤H2OµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
¢ń£®ĻņĮāĆĢæóÖŠ¼ÓČė¹żĮæĻ”H2SO4£¬¹żĀĖ£»
¢ņ£®ĻņĀĖŅŗÖŠ¼ÓČė¹żĮæMnO2£¬¹żĀĖ£»
¢ó£®µ÷½ŚĀĖŅŗpH=a£¬¹żĀĖ£»
¢ō£®ÅØĖõ”¢½į¾§”¢·ÖĄė”¢øÉŌļµĆµ½²śĘ·£»
¢õ£®¼ģŃé²śĘ·“æ¶Č”£
£Ø1£©²½Öč¢ńÖŠ£¬ĀĖŌüµÄÖ÷ŅŖ³É·ÖŹĒ ”£
£Ø2£©½«MnO2Ńõ»ÆFe2+µÄĄė×Ó·½³ĢŹ½²¹³äĶźÕū£ŗ
![]() MnO2 +
MnO2 +![]() Fe2++
Fe2++![]() £½
£½![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
£Ø3£©ÓėŃ”ÓĆCl2×÷ĪŖŃõ»Æ¼ĮĻą±Č£¬MnO2µÄÓÅŹĘÖ÷ŅŖŌŚÓŚ£ŗŌĮĻĄ“Ō“¹ć”¢³É±¾µĶ”¢æɱÜĆā»·¾³ĪŪČ¾”¢ ”£
£Ø4£©ŅŃÖŖ£ŗÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
æŖŹ¼³ĮµķŹ± | 3.4 | 6.3 | 1.5 | 7.6 |
ĶźČ«³ĮµķŹ± | 4.7 | 8.3 | 2.8 | 10.2 |
×¢£ŗ½šŹōĄė×ÓµÄĘšŹ¼ÅضČĪŖ0.1mol/L
²½Öč¢óÖŠaµÄȔֵ·¶Ī§ŹĒ ”£
£Ø5£©²½Öč¢õ£¬Ķعż²ā¶Ø²śĘ·ÖŠĆĢŌŖĖŲµÄÖŹĮæ·ÖŹżĄ“ÅŠ¶Ļ²śĘ·“æ¶Č”£
ŅŃÖŖŅ»¶ØĢõ¼žĻĀ£¬MnO4£ÓėMn2+·“Ӧɜ³ÉMnO2 ”£Č”x g²śĘ·Åä³ÉČÜŅŗ£¬ÓĆ0.1mol/L KMnO4ČÜŅŗµĪ¶Ø£¬ĻūŗÄKMnO4ČÜŅŗy mL£¬²śĘ·ÖŠĆĢŌŖĖŲµÄÖŹĮæ·ÖŹżĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com