
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Al、Cu | 稀盐酸 | 偏向Cu |
2 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
回答下列(1)、(2)小题:
⑴实验1中Al作的电极为____(填“正极”或“负极”),Cu作的电极为____(填“正极"或“负极”)。
⑵实验2观察到C(石墨)棒上产生的现象是____,负极的电极反应式为____.如图是电解质为稀硫酸溶液的氢氧燃料电池。该电池的电子从电极____经过导线流向电极____(填a或b)
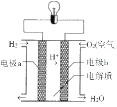
【答案】负极 正极 有少量气泡 Al-3e-=Al3+ a b
【解析】
分析金属活泼性强弱,一般来说活泼性强的为负极,活泼性弱的为正极,电子从负极经导线到正极。
⑴实验1中Al活泼性强,Al与盐酸反应,Cu不盐酸反应,因此Al作的电极为负极,Cu作的电极为正极;故答案为:负极;正极。
⑵实验2中Al为负极,C(石墨)为正极,氢离子在石墨电极上得到电子变为氢气,因此观察到C(石墨)棒上产生的现象是有少量气泡,负极的电极反应式为Al-3e-=Al3+,如图是电解质为稀硫酸溶液的氢氧燃料电池,燃料为负极,氧化剂为正极,因此该电池的电子从电极a经过导线流向电极b;故答案为:少量气泡;Al-3e-=Al3+;a;b。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池----锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法错误的是( )
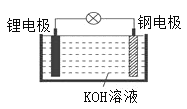
A.锂为负极,钢为正极
B.工作时负极的电极反应式:Li-e-=Li+
C.工作时OH-向锂电极移动
D.放电时电子的流向:锂电极→KOH溶液→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,包含颗粒物(PM2.5)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:①![]() ΔH1=-566.0 kJ·mol-1②
ΔH1=-566.0 kJ·mol-1②![]() ΔH2=-116.5 kJ·mol-1③
ΔH2=-116.5 kJ·mol-1③![]() ΔH3=+180.5 kJ·mol-1,废气中NO2 与CO 转化成无污染气体的热化学方程式为____。
ΔH3=+180.5 kJ·mol-1,废气中NO2 与CO 转化成无污染气体的热化学方程式为____。
(2)研究发现利用NH3可除去硝酸工业尾气中的NO。NH3与NO的物质的量之比分别为1∶2、1∶1.5、3∶1时,NO脱除率随温度变化的曲线如图所示。
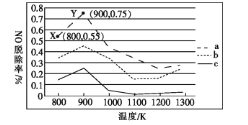
①曲线a中,NO的起始浓度为6×10-4mg·m-3,从X点到Y点经过10 s,则该时间段内NO的脱除速率为___________mg· m-3·s-1。
②曲线c对应的NH3与NO的物质的量之比是___,其理由是___。
(3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO2。活化过程的能量变化模拟计算结果如图所示。

无水情况下,一个氧分子的活化能为__ ,容易活化氧分子的条件是___(填“有水”或“无水”)。
(4)利用反应![]() 构成的电池既能有效消除氮氧化物的排放,减轻雾霾污染,又能充分利用化学能,装置如图所示。
构成的电池既能有效消除氮氧化物的排放,减轻雾霾污染,又能充分利用化学能,装置如图所示。

①B极的电极反应式为___。
②若反应转移1.2 mol电子,A极生成N2的体积为___L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:

已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
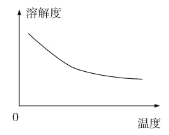
②碳酸锂的溶解度与温度关系如图所示:
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A. ①②③B. ①③④C. ①③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是

A.反应中Fe+是催化剂,FeO+是中间产物B.总反应速率由反应②的速率决定
C.升高温度,总反应的平衡常数K减小D.当有14g N2生成时,转移1mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成与开发大量自然界并不存在的新物质、新材料,并为人类服务是现代化学的重要任务。请结合所学知识回答下列问题:
(1)沙滩上沙粒的主要成分是____。工业上可用沙粒的主要成分与纯碱在高温下反应制备Na2SiO3,该反应的化学方程式为____。
(2)氯气溶于水能杀菌消毒,在新制氯水中滴入紫色石蕊试液的现象是___,该现象说明氯水中含有_______(填化学式或离子符号)。
(3)直接用氯气作漂白剂,难以保存,效果不理想。经过多年的实验、改进,目前常用的是漂白粉。工业制取漂白粉的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应:6NO+4NH3![]() 5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是
5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是
A. ②③B. ③④C. ①②D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是

A.在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B.等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小
C.在pH=3的溶液中存在![]()
D.向Na2CO3溶液中加入过量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com