
【题目】Ⅰ.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________________________________________________
(2)丙组实验混合溶液中离子浓度由大到小的顺序是_____________________________
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=________________mol·L-1, 混合溶液中,c(Na+)-c(A-)=_________________________mol·L-1 (不能做近似计算)。
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)从0~10min内,该反应的平均速率v(H2)=________________ ;该温度下,反应达到化学平衡时,化学平衡常数K=________________ (保留二位小数)
(2)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2 B.3v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)该温度下,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,反应达到平衡过程中,c(H2)c(N2)c(NH3)随时间t变化如图曲线;在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为________

【答案】若a=7,则HA是强酸;若a>7, 则HA是弱酸 c(Na+)>c(A-)>c(OH-)>c(H+) 10-5 10-5-10-9 0.24mol·L-1 ·min-1 0.15mol-2·L2 BC B
【解析】
Ⅰ.(1)甲组等浓度一元酸HA和NaOH溶液等体积混合,两者恰好完全反应生成NaA,依据溶液pH是否大于7判断;
(2)由丙组实验结果可知,混合后为HA与NaA的混合液,pH<7,酸的电离大于盐的水解,溶液显碱性;
(3)丁组实验所得混合溶液为NaA溶液,溶液pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的;
Ⅱ.(1)依据表给数据,结合化学反应速率和化学平衡常数公式计算;
(2)依据平衡时正反应速率等于逆反应速率,各物质浓度保持不变,以及衍生的物理量不变进行分析判断;
(3)温度不变,若起始充入4molN2和12molH2,相当于在原来基础上增加压强,平衡正向移动。
Ⅰ.(1)甲组为0.2 mol·L-1一元酸HA和0.2 mol·L-1NaOH溶液等体积混合,两者恰好完全反应,若HA是强酸,反应生成强酸强碱盐,溶液pH=7,若HA是弱酸,反应生成强碱弱酸盐,溶液pH>7,故答案为:若a=7,则HA是强酸;若a>7, 则HA是弱酸;
(2)由丙组实验结果可知,混合后为HA与NaA的混合液,pH<7,酸的电离大于盐的水解,溶液显碱性,溶液中c(OH-)>c(H+),由电荷守恒可知溶液中c(Na+)>c(A-),则溶液中离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(3)丁组实验所得混合溶液为NaA溶液,溶液pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的,即水电离的溶液中的c(OH-)=10-5mol/L;由电荷守恒可知c(Na+)-c(A-)=c(OH-)—c(H+)=10-5-10-9,故答案为:10-5;10-5-10-9;
Ⅱ.(1)10min时,n(H2)为3.60mol,0~10min内,△c(H2)=(6.00—3.60)mol/1L=2.40 mol/L,平均速率v(H2)=2.40 mol/L/10min=0.24mol/L·min;由表可知表可知25min反应达平衡状态,c(H2)= 3.00mol/L、c(NH3)= 2.00 mol/L,由方程式可知c(N2)=(2.00—1.00)mol/L,化学平衡常数K=c2(NH3)/ c(N2) c3(H2)=( 2.00 mol/L)2/1.00 mol/L×(3.00mol/L)3≈0.15mol-2·L2,故答案为:0.24mol·L-1 ·min-1;0.15mol-2·L2;
(2)A、反应平衡时各物质的浓度是否相等,取决于起始时各物质的量的关系和转化的程度,故A错误;
B、反应达到平衡时,正逆反应速率相等,3v正(N2)=v逆(H2),v正(N2)表示消耗N2的速率,v逆(H2)表示生成H2的速率,且v正(N2):v逆(H2)=1:3,充分说明向两个相反方向进行的程度相当,故B正确;
C、该反应是反应前后气体体积有变化的反应,所以达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,该容器中的压强不再变化时,反应达到平衡状态,故C正确;
D、根据质量守恒,反应前后混合气体的质量不变,容器的体积不变,所以混合气体的密度始终不变,不能证明该反应是否达到平衡状态,故D错误;
故选BC,故答案为:BC;
(3)由反应方程式可知各物质变化量之比等于对应物质的化学计量数之比,而△n甲:△n乙:△n丙=3:1:2,所以表示甲为H2变化量、乙为变化量、丙为NH3变化量,在此温度下,若起始充入4molN2和12molH2,相当于在原来基础上增加压强,平衡正向移动,所以比原平衡的两倍小,而且达平衡的时间缩短,则对应是点B,故答案为:B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】室温下,把下列各题的结果填在横线上。
(1)c(OH-)=1×10-3mol/L的溶液的pH=___________________
(2)0.01mol/L HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=_________________
(3)某溶液由水电离出H+的物质的量的浓度c(H+)= 1×10-5mol/L,则该溶液可以是______(填“硫酸”或“氯化铵”或 “氢氧化钠” 或“氯化钠”)溶液
(4)将0.39g过氧化钠溶于足量水中并配成100 mL溶液,则溶液的pH=_____________
(5)0. 12mol/L HCl溶液与0.1mol/L 的NaOH溶液等体积混合,混合液的pH=___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HCl→C6H5COOH+NaCl,有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | ﹣15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21 g | 0.34 g | 5.9 g |
实验流程如下:
(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。若将仪器B改为仪器C,效果不如B,说明原因________。

(2)操作中有关分液漏斗的使用不正确的是___。
A.分液漏斗在使用之前必须检查是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时等下层液体放完后立即关闭旋塞,换一个烧杯再打开旋塞使上层液体流下
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为_______。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后洗涤晶体。
(5)用电子天平准确称取0.244 0 g苯甲酸样品于锥形瓶中,加100 mL蒸馏水溶解(必要时可以加热),再用0.100 0 molL﹣1的标准NaOH溶液滴定,共消耗NaOH溶液19.20 mL,则苯甲酸样品的纯度为___%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2是一种化工原料,可以制备一系列物质,下列说法正确的是
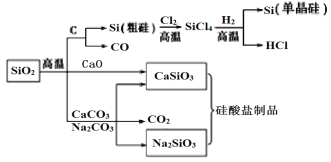
A. 图中所有反应都不属于氧化还原反应
B. 硅酸盐的化学性质稳定,常用于制造光导纤维
C. 可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸盐
D. 普通玻璃是由纯碱、石灰石和石英制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日本产业技术综合研究所发布的锂空气电池的设计构思是负极采用金属锂条,中间设有用于隔开正极和负极的锂离子固体电解质,正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合,既可以用作充电电池也可用作燃料电池使用,结构如图所示。下列有关该锂空气电池说法不正确的是( )
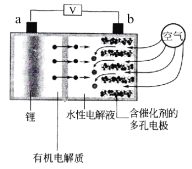
A.电池放电时,Li+穿过隔膜向b极移动得到LiOH溶液
B.放电时,外电路的电子由a经外电路流向b
C.充电时,a电极的电极反应为:Li+ + e- ═ Li
D.放电时,b极发生的电极反应为O2 - 4e- + 2H2O ═ 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法错误的是( )

A.a为外接直流电源的负极
B.阳极的电极反应为2HCl - 2e- ═ Cl2 + 2H+
C.通电后H+从左室迁移至右室
D.左室中发生反应为4Fe2+ + O2 + 4H+ ═ 4Fe3+ + 2H2O,实现了Fe3+的再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 若将等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B. C(s,石墨)= C(s,金刚石) ΔH﹦+1.5kJ/mol,结论:相同条件下金刚石性质比石墨稳定
C. CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) △H﹦-801.3kJ/mol, 结论:CH4的燃烧热△H﹦-801.3kJ/mol
D. N2(g) + 3H2(g)![]() 2NH3(g) ΔH﹦-92.4kJ/mol,结论:在密闭容器中充入0.5molN2、1.5molH2,充分反应后放出46.2kJ的热量
2NH3(g) ΔH﹦-92.4kJ/mol,结论:在密闭容器中充入0.5molN2、1.5molH2,充分反应后放出46.2kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+ 6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡。下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol·L-1) | 物质的平衡浓(mol·L-1) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 0.60 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(C2H5OH ,甲)﹦c(C2H5OH ,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com